物质在水溶液中存在的电离平衡、水解平衡和沉淀溶解平衡,都可看作化学平衡。请根据所学知识回答:
(1)在0.1mo1·L-1的NaHSO3溶液中存在的各种平衡体系为(用离子方程式表示): 、 、 。
已知该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO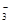 )>c(SO
)>c(SO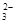 )>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
)>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
(2)常温下,某水溶液中存在的离子有:Na+、A—、H+、OH—,若该溶液由0.1mo1.L-1的HA溶液和0.1mol.L-1的NaOH溶液等体积混合而得,则溶液的pH (填“大于”、“小于”或“等于”)7,理由是 。
有机玻璃是一种重要的塑料,有机玻璃的单体A(C5H8O2)不溶于水,并可以发生以下变化,请回答: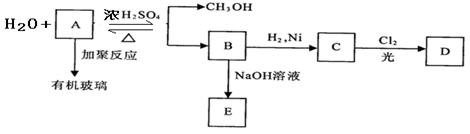
(1) B分子中含有的官能团名称是_____________, _____________。
(2) 由B转化为C的反应属于(选填序号) _____________。
① 氧化反应② 还原反应③ 加成反应 ④ 取代反应
④ 取代反应
(3) C的一氯代物D有两种,C的结构简式是_____________。
(4) 由A生成B的化学方程式是___________________________ ________________。
________________。
(5) 有机玻璃的结构简式是____________________________________。
在一定温度下,将2mol A和2mol B两种气体相混合于体积为
2 L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g) x C(g)+2D(g)
x C(g)+2D(g)  H <0, 2min末反应达到平衡状态(温度不变),生成了0
H <0, 2min末反应达到平衡状态(温度不变),生成了0 .8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)X的值等于。
(2)计算该反应的化学平衡常数K=,升高温度时K值
将(选填“增大”、“减小”、“不变”)。
(3)A的物质的转化率为。
(4)若维持温度不变,在原平衡混合物的容器中再充入3mol C和3mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为mol;达新平衡时,A的物质的量为n(A)= mol。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为____________,
在X极附近观察到的现象是 :______________________;
Y电极上的电极反应式是_________________________,
检验该电极反应产 物的方法是:_______________________________。
物的方法是:_______________________________。
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是_________,电极反应式是________________________。
(15分)
分别由C、H、O三种元素组成的有机物A、B、C互为同分异构体,它们分子中C、H、O元素的质量比为15︰2︰8,其中化合物A的质谱图如下。
A是直链结构,其核磁共振氢谱有三组峰,且峰面积之比为1︰1︰2,它能够发生银镜反应。B为五元环酯。C的红外光谱表明其分子中 存在甲基。其它物质的转化关系如下:
存在甲基。其它物质的转化关系如下:
⑴A的分子式是:。A分 子中的官能团名称是:。
子中的官能团名称是:。
⑵B和G的结构简式分别是:、。
⑶写出下列反应方程式(有机物用结构简式表示)
D→C;
H→G。
⑷写出由单体F分别发生加聚反应生成的产物和发生缩聚反应生成的产物的结构简式:、。
(15分)
X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的。W是同周期元素中离子半径最小的元素。M原子的最外能层上有两个运动状态不同的电子。N是一种“明星金属”,广泛应用于航天、军事等工业领域。请回答下列问题:
⑴X、Y两种元素的元素符号是:、。X、Y可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是:;中心原子的杂化方式是:。
⑵X的氢化物易溶于水的其原因是:。
⑶N的电子排布式是:。
⑷X和Y两元素的第一电离能大小关系:小于(填元素符号)。
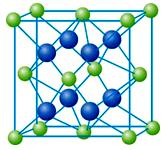
⑸M与Y形成的化合物的晶体类型属于:;其晶胞如图所示,其中M离子的配位数是:。