碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=" —1214" kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=" —566" kJ/mol
则表示甲烷燃烧热的热化学方程式 。
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积
为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
1 |
2 |
0.4 |
1 |
①实验1中,以v (H2)表示的平均反应速率为 。
②实验3跟实验2相比,改变的条件可能是 (答一种情况即可)
(1)写出表示含有8个质子、10个中子的原子的化学符号。
(2)元素周期表中,所含元素超过18种的周期是。
(3)葡萄糖的结构简式是
下列A~H 八种物质存在如下图所示的转化关系(反应条件、部分产物未标出)。已知A是正盐,B能使品红溶液褪色,G是红棕色气体。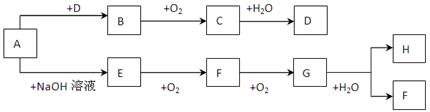
试回答下列问题:
(1)写出下列各物质的化学式 A
(2)按要求写出下列反应的有关方程式
E→F反应的化学方程式;
G→H反应的离子方程式。
(3)写出H的浓溶液与木炭反应的化学方程式。
(4)检验D中阴离子的方法是
分析下列列氧化还原反应,回答有关问题。
(1) 2KMnO4+10KI+8H2SO4 =6K2SO4+ 2MnSO4 +5I2十8H2O
被还原的元素,发生氧化反应的物质。
(2) 3Cl2+ 6NaOH=5NaCl + NaClO3+ 3H2O
氧化剂与还原剂的物质的量之比为。
废物回收利用可实现资源再生,并减少污染。如废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末,废旧玻璃也可回收再生。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是(填字母)。
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用H2O2和H2SO4(ag)的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq) ====Cu2+(aq)+H2(g)ΔH=+64.39kJ·mol-1
2H2O2(l) ====2H2O (l)+O2(g)ΔH=-196.46kJ·mol-1
H2(g)+ 1/2 O2(g) ="===" H2O (l)ΔH=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O (l)的热化学方程式为
。
(3)氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25 ℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
则表示氢氟酸电离的热化学方程式为:
可见氢氟酸的电离是 的(填吸热或放热)。
某原电池构造如下图所示。其电池的总反应是:Cu(s) + 2Ag+ (aq) = Cu2+ (aq) + 2Ag(s)。
请回答以下问题:
(1)若盐桥为琼脂-KOH组成,其作用是___________________________。OH-离子移向_______(填“A”或“B”)中的溶液。Cu为原电池的______极,其电极反应式是_____________________________。A中的电解质溶液在该电池工作一段时间后会出现_______________________的现象。
(2)把盐桥改为铁棒后,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 (填“原电池”或“电解池”),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)(提示:当两个原电池串联时,电极材料的金属活动性相差较大的为原电池,电极材料的金属活动性相差较小的为电解池)。
(3)把盐桥改为铜棒后,电流计的指针 (填“会”、“不会”)发生偏转,左边烧杯中的硝酸铜浓度 (填“增大”、“减小”或“不变”)
(4)把盐桥改为银棒后,电流计的指针 (填“会”、“不会”)发生偏转,理由是 。