废物回收利用可实现资源再生,并减少污染。如废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末,废旧玻璃也可回收再生。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用H2O2和H2SO4(ag)的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq) ====Cu2+(aq)+H2(g) ΔH=+64.39kJ·mol-1
2H2O2(l) ====2H2O (l)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ 1/2 O2(g) ="===" H2O (l) ΔH=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O (l)的热化学方程式为
。
(3)氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25 ℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
则表示氢氟酸电离的热化学方程式为:
可见氢氟酸的电离是 的(填吸热或放热)。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴煤的气化的主要化学反应方程式为:___________________________。
⑵煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_____________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)在某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)在某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
化合物SOCl2是一种液态 化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消
化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消 失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
(1)根据上述实验,写出SOCL2和水反应的化学方程式 __.
__.
(2)AlCl3溶液蒸干灼 烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 ____________________________________________.
烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 ____________________________________________.
由短周期元素组成的 A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
(1)A和B的混合物溶于水发生反应的离子方程式______________________________.
(2)B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的离子方程式__________________________________________________.
铝土矿的主要成分为Al2O3。生产铵明矾[NH4Al(SO4)2·12H2O]和Z(其水溶液可用于伤口消毒)的工艺流程图如下: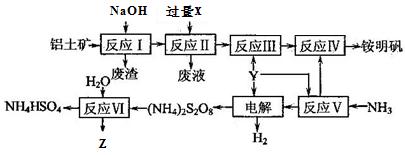
(1)反应Ⅰ的主要离子方程式是__________________________。
(2)已知反应Ⅱ中会生成氢氧化铝沉淀,则加入过量的X为_________(填化学式)。
(3)“电解”时,用惰性材料作电极,则阴极反应可表示为 _________。
(4)流程中可以循环使用的物质是。
(5)反应Ⅵ的化学方程式为 __________,其中的还原剂是____________。
(6)已知铵明矾的许多用途和明矾类似,请说明铵明矾的净水原理_________________________ 。
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
第1步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l)△H1=" —330.0" kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l)△H1=" —330.0" kJ·mol-1
第2步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)△H2="+226.3" kJ·mol-1
H2O(l)+H2NCONH2(l)△H2="+226.3" kJ·mol-1
(1)写出工业合成尿素的热化学方程式:
(2)下列措施中有利于提高尿素的产率的是___________。
| A.采用高温 | B.采用高压 | C.添加高效催化剂 | D.定时分离尿素 |
(3)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图所示: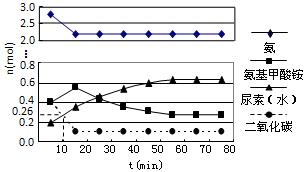
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)=。
(4)工业上合成氨常与尿素生产联合进行以提高经济效益,合成氨的热化学方程式如下:
N2(g) + 3H2(g)  2NH3(g)△H = —92.4 kJ/mol
2NH3(g)△H = —92.4 kJ/mol
请在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)。
(5)有一工业投产前小实验:在一定温度和压强下,将6 molH2和2 molN2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数约为11.1%(即1/9),此时H2的转化率是多少?(写出计算过程,计算结果保留3位有效数字。)