二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴煤的气化的主要化学反应方程式为:___________________________。
⑵煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_____________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)在某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)在某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
某学校化学探究小组将地瓜干制成粉末,加入水、稀硫酸进行发酵水解实验:
(1)经过一段时间后,为了检验水解产物中是否含有葡萄糖,该小组的同学取出水解产物的溶液少许,放入试管中,加水进行稀释,在稀释液中滴入新制的氢氧化铜悬浊液,加热煮沸,结果没有红色沉淀产生,其原因是________(填序号)。
A.水解还没有开始
B.水解进行的不完全
C.水解液没有加碱中和其酸性
D.水解的产物中没有葡萄糖
(2)在指导老师的帮助下,通过查阅资料,他们知道发酵液中含有A、B、C、D等多种化合物。并通过资料,他们知道了以下实验事实:
①A和C均可与银氨溶液反应,析出金属银,A是一种常见的单糖;
②B是单官能团化合物,其碳原子数和D相同。B在浓硫酸作用下经加热可得到E,E可以使溴水褪色;
③B经催化氧化可生成C;
④B和D在浓硫酸和加热条件下反应可以得到F;
⑤D的组成为C:40%,H:6.7%;O:53.3%。D含有一个羧基,450 mg D与0.2 mol·L-1的NaOH溶液25 mL完全反应,D也可和乙酸发生酯化反应;
请你根据上述事实,写出产物中A、D、F的一种可能的结构简式。
A:_____________________________________________;
D:_____________________________________________;
F._____________________________________________。
有A、B、C三种无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③A、C均能发生水解反应,水解液均能发生银镜反应。
(1)试判断它们各是什么物质:A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式:
A:_____________________________________________。
C:_____________________________________________。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)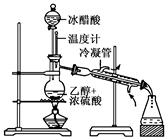
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______________________________________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:
__________________________________________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1 mol乙酸乙酯?________,原因是__________________________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。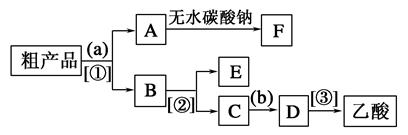
试剂a是__________,试剂b是__________;分离方法①是________,分离方法②是________,分离方法③是______。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________________。
苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效,苹果醋是一种常见的有机酸,其结构简式为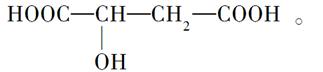
(1)苹果醋中含有的官能团的名称是________、________。
(2)苹果醋的分子式为________。
(3)1 mol苹果醋与足量Na反应,能生成标准状况下的H2________L。
(4)苹果醋可能发生的反应是________。
| A.与NaOH溶液反应 |
| B.与石蕊试液作用 |
| C.与乙酸在一定条件下发生酯化反应 |
| D.与乙醇在一定条件下发生酯化反应 |
分子式为C3H8O的液态有机物A 1 mol,与足量的金属钠作用,可以生成11.2 L H2(标准状况),则A分子中必含有一个____________(填官能团的名称)。若该官能团位于碳链的一端,则A的结构简式为____________。A与浓硫酸共热170℃以上,发生分子内脱水的反应,该反应方程式为__________________。A在铜作催化剂时,与氧气共热,可以生成C,写出该氧化反应的化学方程式______________________。