按下图装置进行实验,并回答下列问题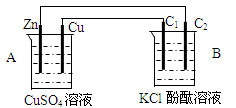
(1)判断装置的名称:A池为 B池为
(2)铜极为______极,电极反应式为
(3)B装置中,C1与C2均为石墨棒,石墨棒C1为___极,电极反应式为 ,石墨棒C2附近发生的实验现象为
(4)当C2极析出224mL(标准状态)气体时,锌的质量减少 g.
【化学–选修3:物质结构与性质】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是(填元素符号,下同),电负性最大的是。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式,1 mol AB-中含有π键的数目为,黄血盐晶体中各种微粒间的作用力不涉及(填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.分子间的作用力
(3)E2+的价层电子排布图为,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③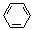 、④HCHO。其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)。
、④HCHO。其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F 两种晶体晶胞中金属原子的配位数之比为。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为。
[化学——选修3]物质结构与性质:(15分)有A、B、C、D、E五种元素。其相关信息如下:
请回答下列问题。
(1)写出E元素原子基态时M层的电子排布式。
(2)C元素单质分子中含有δ和∏键的键数之比为。
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是::C2A4分子中c原子轨 道的杂化类型是。
(4)A、C、E三种元素可形成:【E(CA3)4】2+配离子,其中存在的化学键类型有(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若【E(CA3)4】2+具有对称的空间构型.且当【E(CA3)4】2+中的两个CA3分子被两个Cl一取代时.能得到两种不同结构的产物,则【E(CA3)4】2+的空间构型为(填序号)。
a.平面正方形 b.正四面体c.三角锥型d.V型
(5)B与D可形成离子化合物.其晶胞结构如图所示。其中D离子的配位数为.若该晶体的密度为a g·cm-3,则该晶胞中距离最近的B和D之间的距离是cm(写出表达式即可,NA代表阿伏加得罗常数)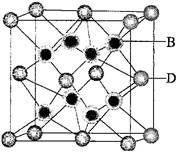
【化学选修3-物质结构与性质】(15分)a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
| a |
原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| b |
基基态原子的P轨道电子数比s轨道电子数少1 |
| c |
在周期表所列元素中电负性最大 |
| d |
位于周期表中第4纵行 |
| e |
基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种_________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm ,则晶胞的体积为________(
,则晶胞的体积为________(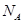 用表示阿伏加德罗常数的值)。
用表示阿伏加德罗常数的值)。
(14分)醇是重要的有机化工原料。一定条件下,甲醇可同时发生下面两个反应:
i .2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ii.2CH3OH(g) C2H4(g)+2H2O(g)
C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应________(填“i”或“ii”)的速率较大,其原因为___________。若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1__________;E2-E1___________(填“增大”、“减小”或“不变”)。
(2)已知:CH3CH2OH(g)=CH3OCH3(g) H=+50.7 kJ·mol-1。则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的H=。
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2 L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
| 起始投料 编号 |
CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
| 恒温容器1 |
2 |
0 |
0 |
| 恒温容器2 |
0 |
2 |
2 |
| 绝热容器3 |
2 |
0 |
0 |
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)________c2(H2O)(填 “>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为__________。
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K="______________" .
煤的气化产物CO和H2是重要的化工原料。某些简单的有机物和CO反应合成具有优良性能材料的基本过程如图所示。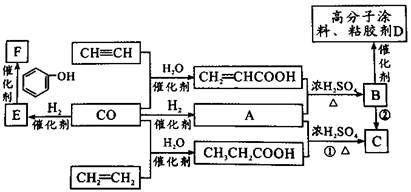
已知:①E由CO和H2按物质的量之比为1:1完全反应而成;
②A由CO和H2按物质的量之比为1:2完全反应而成。
回答下列问题:
(1)E的结构简式;B中的官能团名称。
(2)下列说法不正确的是。
A.HC CH可以与氯化氢反应,得到氯乙烯 CH可以与氯化氢反应,得到氯乙烯 |
| B.CH2=CH2可由石油裂化得到,一定条件下可制得聚乙烯塑料 |
| C.由B生成D的反应类型是加聚反应 |
| D.可用溴水鉴别CH3CH2COOH与CH2=CHCOOH |
(3)写出反应①的化学方程式,属于反应。