电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下:
(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、 和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有 (填化学式),加入CO3(PO4)2的目的是 。
(3)Co与稀硝酸反应生成 Co2+的离子方程式为: 。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式:
①AB段: ;
②BC段 。
利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
I、B与醋酸反应: ▲, ▲反应。
II、B→C: ▲, ▲反应。
(2)可用于检验A的试剂是▲。
(3)用淀粉[(C6H10O5)n]为原料制取B,若有含淀粉40%的植物果实1kg,经反应制得184g的B,则淀粉的转化率为 ▲。(提示:转化率=已反应的量/原有的量×100%)
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:



 已知:
已知: ,
,
请回答下列问题: (1)A与银氨溶液反应有银镜生成,则A的结构简式是 ▲。
(1)A与银氨溶液反应有银镜生成,则A的结构简式是 ▲。 (2)B→C的反应类型是 ▲。
(2)B→C的反应类型是 ▲。 (3)E的结构简式是 ▲。
(3)E的结构简式是 ▲。 (4)写出F和过量NaOH溶液共热时反应的化学方程式:
(4)写出F和过量NaOH溶液共热时反应的化学方程式: ▲。
▲。 (5)下列关于G的说法正确的是()
(5)下列关于G的说法正确的是() a.能与溴单质反应 b..能与金属钠反应
a.能与溴单质反应 b..能与金属钠反应 c.1molG最多能和3mol氢气反应 d.分子式是C9H7O3
c.1molG最多能和3mol氢气反应 d.分子式是C9H7O3
(6)写出与D互为同分异构体且含苯环、属于酯类的结构简式:
工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
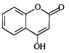
⑴这种阳离子交换膜,只允许溶液中的 ▲通过。(填下列微粒的编号)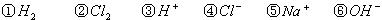
⑵写出在电解过程中阳极发生的电极方程式: ▲。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
▲。
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中阴极发生的电极方程式 ▲。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: ▲。
最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是Ca3(PO4)2,具体生产磷铵流程如下: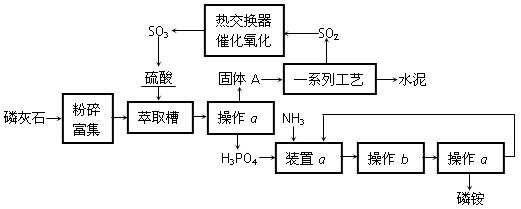
回答下列问题:
(1)操作a的名称是 ▲,实验室中进行此操作的非玻璃仪器或用品有 ▲;在实验室中操作b的名称是 ▲。
(2)装置a中生成两种酸式盐,它们的化学式分别是 ▲。
(3)依题意猜测固体A中一定含有的物质的化学式是 ▲(结晶水部分不写)。
(4)热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是 ▲。
(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是 ▲。(选填字母)
| A.NaOH溶液、酚酞试液 | B.KMnO4溶液、稀H2SO4 |
| C.碘水、淀粉溶液 | D.氨水、酚酞试液 |
(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的元素符号为 ▲;M在元素周期表中的位置为 ▲;五种元素的原子半径从大到小的顺序是 ▲(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为 ▲,B的结构式为 ▲。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ▲。
(4)写出由X、Z、L三种元素组成的离子化合物与稀NaOH溶液反应的离子方程式:
▲。
(5)Z2H4和ZO2是一种双组分火箭推进剂。两种物质混合发生反应生成Z2和X2O(g),已知8g气体Z2H4在上述反应中放出142kJ热量,其热化学方程式为 ▲。