(1)①25 ℃时,将20 mL 0.1 mol·L-1CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。 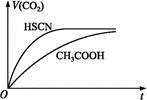
反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”“<”或“=”)。
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)。
| A.c(CH3COO-) | B.c(H+) | C.KW | D.醋酸电离平衡常数 |
E.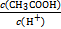
(2)下图为某温度下,PbS(s).ZnS(s).FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度.金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+.Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。 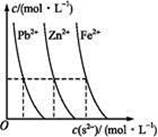
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ,c(H2C2O4) c(C2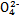 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)则原溶液中肯定存在的离子是________________________,肯定不存在的离子是___________________________,依次写出步骤②中所发生反应的离子方程式______________________________________________________________________________;
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?______(填“有”或“无”)。
含有少量二价锰盐的溶液,在浓HNO3中与PbO2混合煮沸,溶液呈现紫红色,PbO2转化为Pb(NO3)2,反应中无气体生成,该反应的离子方程式为_____________________,每消耗1mol氧化剂,被氧化的还原剂的物质的量为_______mol。
现有以下物质:①NaCl晶体②液态SO3③液态的醋酸④汞⑤Ba2SO4固体⑥纯蔗糖(C12H22O11)⑦酒精(C2 H5OH)⑧熔化的KNO3,请回答下列问题(用序号):
(1)以上物质中能导电的是___________。
(2)以上物质中属于电解质的是__________。
(3)以上物质中属于非电解质的是__________。
(4)以上物质中溶于水后形成的水溶液能导电的是__________。
(4分)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) |
|||||||
| (mol/L) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
| 103c(PbCl2) |
|||||||
| (mol/L) |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是________。
| A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
| B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
| C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
| D.PbCl2固体可溶于饱和食盐水 |
(8分)电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用铬元索,此工业废水通常采用如下流程处理:
已知:
(1)铬元素有以下循环过程:
(2) Cu(OH)2能溶于氨水:
请回答下列问题:
(1)加入试剂甲的目的:________________
(2)试剂乙的名称:__________ ,试剂丙的化学式:________________
(3)上述操作I、II、III相同,则进行该实验操作所需要的主要玻璃仪器有___________
(4)滤渣I的主要成分为________________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:________________
(6) 铬元素循环过程的反应⑥的离子方程式:________________;废水处理流程中生成滤渣III的离子方程式:________