(4分)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) |
|
|
|
|
|
|
|
| (mol/L) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
| 103c(PbCl2) |
|
|
|
|
|
|
|
| (mol/L) |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是________。
| A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
| B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
| C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
| D.PbCl2固体可溶于饱和食盐水 |
(8分) 已知可充电电池是一种可反复使用的电池。铅蓄电池是生活中常用的可充电电池,其充电过程与放电过程是完全相反的两个过程。其反应总方程式为:
请回答下列问题:放电时,给出电子的一极是(填电极名称),发生反应(填反应类型),其电极反应式为:。该极充电时将发生反应(填反应类型)。
(1)有几种元素的微粒电子层结构如图 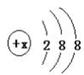 所示,其中:
所示,其中:
①某电中性微粒一般不和其他元素的原子反应,这种微粒符号是________。
②某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒的电子式是______。
③某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒符号是__。
④某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是__
(2)11—18号元素中,其单质相互化合能形成种离子化合物,最高价氧化物对应水化物酸性最强的元素是;最高价氧化物对应水化物碱性最强的物质的化学式为;气态氢化物稳定性最强的物质的电子式是________。
反应
 过程中的能量变化如图所示,回答下列问题。
过程中的能量变化如图所示,回答下列问题。
(1)该反应是反应(填"吸热""放热");
(2)当反应达到平衡时,升高温度,
的转化率(填"增大""减小""不变"),原因是;
(3)反应体系中加入催化剂对反应热是否有影响?,原因是:
(4)在反应体系中加入催化剂,反应速率增大,
和
的变化是:
,
(填"增大""减小、""不变")。
在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+Br2(g)  2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr(见下表的“已知”项),在相同条件下,且保持平衡时各组分的含量不变,对下列编号(1)~(3)的状态,填写表中的空白。
2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr(见下表的“已知”项),在相同条件下,且保持平衡时各组分的含量不变,对下列编号(1)~(3)的状态,填写表中的空白。
| 编号 |
起始状态(mol) |
平衡时HBr(g) 物质的量(mol) |
||
| H2 |
Br2 |
HBr |
||
| 已知 |
1 |
2 |
0 |
a |
| (1) |
2 |
4 |
0 |
|
| (2) |
1 |
0.5 a |
||
| (3) |
m |
n(n≥2m) |
、已知可逆反应:
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol,L-1, c(N)="2.4" mol·L-1; 达到平衡后,M的转化率为60%,此时N的转化率为;
(2)若反应温度升高,M的转化率(填“增大”、“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4mol,L-1, c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a= (要求写出计算过程) ;
(4)若反应温度不变,反应物的起始浓度为:c(M)=" c(N)=b" mol,L-1,达到平衡后,M的转化率为
(要求写出计算过程)。