将KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是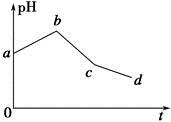
| A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H++2e-=H2↑不可能同时发生 |
| B.电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度 |
| C.ab段表示电解过程中H+被还原,pH上升 |
| D.原混合溶液中KCl和CuSO4的浓度之比恰好为2∶1 |
能正确表示下列反应的离子方程式是()
| A. | 浓盐酸与铁屑反应: |
| B. | 钠与 溶液反应: |
| C. | 溶液与稀 反应: |
| D. | 向 溶液中加入 : |
为阿伏伽德罗常数的值,下列叙述正确的是()
| A. | 1.0 1.0 的 水溶液中含有的氧原子数为2 |
| B. | 12 石墨烯(单层石墨)中含有六元环的个数为0.5 |
| C. | 25℃时 =13的 溶液中含有 的数目为0.1 |
| D. | 1 的羟基与1 的氢氧根离子所含电子数均为9 |
下列叙述中,错误的是()
| A. | 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
| D. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
下列叙述错误的是()
| A. | 生物柴油由可由再生资源制得 | B. | 生物柴油是不同酯组成的混合物 |
| C. | 动植物油脂是高分子化合物 | D. | "地沟油"可用于制备生物柴油 |
下列实验中,所采取的分离方法与对应原理都正确的是()
| 选项 |
目的 |
分离方法 |
原理 |
| A. |
分离溶于水中的碘 |
乙醇萃取 |
碘在乙醇中的溶解度较大 |
| B. |
分离乙酸乙酯和乙醇 |
分液 |
乙酸乙酯和乙醇的密度不同 |
| C. |
除去 固体中混杂的 | 重结晶 |
在水中的溶解度很大 |
| D. |
除去丁醇中的乙醚 |
蒸馏 |
丁醇与乙醚的沸点相差较大 |