等物质的量的苛性钠溶液分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb则两者的关系正确的是
| A.Va>Vb | B.Va=10Vb | C.Vb<10Va | D.Vb>10Va |
下列原子各电子层中电子数不合理的是
| A.Sc:K(2) L(8) M(8) N(3) | B.Cr:K(2) L(8) M(13) N(1) |
| C. Ge:K(2) L(8) M(18) N(4) | D.Cu:K(2) L(8) M(18) N(1) |
NA表示阿伏加德罗常数的值,下列说法不正确的是
| A.在标准状况下,2.24L CCl4中含有C—Cl键的数目为0. 4NA |
B.0.2molPCl5分子中,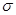 键数目为NA 键数目为NA |
| C.28g聚乙烯分子中含有的碳原子数为2NA |
| D.0.1mol椅式环已烷所含C—C数目为0.6NA |
基态原子的4s能级中只有1个电子的元素共有
| A.1种 | B.2种 | C.3种 | D.8种 |
x 、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
| A.x的原子半径大于y的原子半径 |
| B.x的电负性大于y的电负性 |
| C.x阴离子的半径小于y阳离子的半径 |
| D.x的第一电离能小于y 的第一电离能 |
用R代表短周期元素,R原子最外层的p能级上的未成对电子只有2个。下列关于R的描述中正确的是
| A.R的氧化物都能溶于水 |
| B.R都是非金属元素 |
| C.R的氧化物都能与NaOH反应 |
| D.R的最高价氧化物对应的水化物都是H2RO3 |