某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(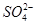 )
)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是
| A.全部 | B.③⑤⑥ | C.④⑤⑥ | D.①②④ |
下列各组物质气化或熔化时,所克服的微粒间的作用(力),属同种类型的是
| A.碘和干冰的升华 | B.二氧化硅和生石灰的熔化 |
| C.氯化钠和铁的熔化 | D.氯化钠和氯化氢分别溶于水 |
以下关于元素周期表的结构叙述正确的是
| A.有七个主族,八个副族 |
| B.有三个长周期(均含18种元素),三个短周期(均含8种元素) |
| C.零族位于元素周期表的第18列(从左往右) |
| D.第ⅢA族位于元素周期表的第三列(从左往右) |
下列叙述中,不正确的是
| A.元素最高化合价:Na<Mg<Al | B.元素非金属性:N>O>F |
| C.酸性:H3PO4<H2SO4<HClO4 | D.原子核外电子层数:Li<Na<K |
某元素的离子结构示意图为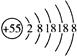 ,该元素在周期表中的位置是
,该元素在周期表中的位置是
| A.第5周期零族 | B.第6周期第IB族 | C.第5周期第ⅦA族 | D.第6周期第IA族 |
在元素周期表中,在金属元素与非金属元素的分界线附近可以找到考资

| A.作为催化剂的材料 | B.电子工业上的半导体材料 |
| C.制造农药的材料 | D.制造耐高温材料 |