某元素的离子结构示意图为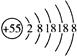 ,该元素在周期表中的位置是
,该元素在周期表中的位置是
| A.第5周期零族 | B.第6周期第IB族 | C.第5周期第ⅦA族 | D.第6周期第IA族 |
某学生做乙醛还原的实验,取1 mol·L-1的硫酸铜溶液2 mL和0.4 mol·L-1的氢氧化钠溶液4 mL,在一支试管里混合加入0.5 mL 40%的乙醛溶液加热至沸腾,无红色沉淀,实验失败的原因是()
| A.NaOH不够量 | B.CuSO4不够量 |
| C.乙醛溶液太少 | D.加热时间不够 |
茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:
关于茉莉醛的下列叙述错误的是()
| A.在加热和催化剂作用下,能被氢气还原 | B.能被高锰酸钾酸性溶液氧化 |
| C.在一定条件下能与溴发生取代反应 | D.不能与氢溴酸发生加成反应 |
甲醛在一定条件下发生如下反应:2HCHO+NaOH HCOONa+CH3OH,在此反应中关于甲醛的下列叙述中正确的是()
HCOONa+CH3OH,在此反应中关于甲醛的下列叙述中正确的是()
| A.仅被氧化 | B.仅被还原 |
| C.既被氧化又被还原 | D.既未被氧化又未被还原 |
一般情况下,下列官能团中既具有氧化性又有还原性的是()
| A.—OH | B.—CHO | C.—SO3H | D.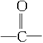 |
已知丁基有4种,据此不必试写,即可断定C5H10O的醛应有()
| A.3种 | B.4种 | C.5种 | D.6种 |