下列说法或表示法正确的是
| A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多 |
| B.需要加热的反应说明它是吸热反应 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l),ΔH=-57.3 kJ/mol,若将含0.5 mol H2SO4 的稀硫酸与含1.1 mol NaOH的稀溶液混合,放出的热量等于 57.3 kJ |
| D.1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2==SO2ΔH=-297.3 kJ/mol |
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去),下列说法不正确的是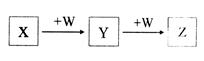
A.若 W是单质铁,则Z溶液可能是 W是单质铁,则Z溶液可能是 FeCl2溶液 FeCl2溶液 |
| B.若W是氢氧化钠,则X与Z可反应生成Y |
| C.若X是碳酸钠,则W可能是盐酸 |
| D.若W为氧气,则Z与水作用(或溶于水)一定生成一种强酸 |
某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列叙述中对实验原理的解释和结论不正确的是
| A.氧化性:HClO>I2>SO42— |
| B.淀粉KI溶液变蓝是因为I—被氧化为I2,淀粉遇I2变蓝 |
| C.蓝色消失的原因是Na2SO3溶液具有漂白性 |
| D.若将Na2SO3溶液加入氯水中,氯水退色 |
为测写某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100mL0.3mol·L—1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560mL;再加0.2mol·L—1NaOH溶液至沉淀质量恰在此时好不再变化,用去350mL NaOH溶液。则所取样品中铝的物质的量为
| A.0.005mol | B.0.01mol | C.0.025mol | D.0.03mol |
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O→NaOH+NH3 NaH+H2O→NaOH+H2
有关它们的叙述正确的是
| A.离子半径:N3—>Na+>H+ |
| B.与水反应都是氧化还原反应 |
| C.与盐酸反应都只生成一种盐 |
| D.两种化合物中的阴阳离子均具有相同的电子层结构 |
四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z—离子的电子数之差为8。下列说法不正确的是
| A.与W想邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
| D.X的单质在W的最高价氧化物中的燃烧反应属于置换反应 |