甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。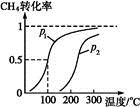
①已知100 ℃压强为p1时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为 。
②图中的p1 p2(填“<”“>”或“="”),100" ℃压强为p2时平衡常数为 。
③该反应的ΔH 0(填“<”“>”或“=”)。
(2)在一定条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g) ΔH<0 ……Ⅱ
CH3OH(g) ΔH<0 ……Ⅱ
①若容器容积不变,下列措施可增加甲醇产率的是( )
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验表格中。
A.下表中剩余的实验条件数据:a= ;b= 。
。
B.根据反应Ⅱ的特点,下图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px= MPa。
| 实验编号 |
T/℃ |
n(CO)/n(H2) |
p/MPa |
| 1 |
150 |
1/3 |
0.1 |
| 2 |
a |
1/3 |
5 |
| 3 |
350 |
b |
5 |
知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。

(1)图1中,电解一段时间后,气球b中的气体是___________(填化学式),U形管__________(填“左”或“右”)边的溶液变红。
(2)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则c为电源的________极;该发生器中反应的总离子方程式为___________________。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质传输与转化关系如图3所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
图3
①燃料电池B中的电极反应式分别为:负极_______________,正极______________。
②分析图3可知,氢氧化钠的质量分数a%、b%、c%由大到小的顺序为___________。
高分子化合物PTT是一种性能优异的新型纤维,是当前国际上最新开发的热门高分子新材料。PTT的一种合成路线如下图:

(1)已知A→B是加成反应,B的结构简式为______________,C分子中含有的官能团是_____________。
(2)用系统命名法给有机物D进行命名_______________________________。
(3)芳香烃E的相对分子质量为106,E的一氯代物只有2种,则E的结构简式为___________。
(4)E→F的反应类型为________反应,合成PTT的化学方程式为____________。
(5)有机物I的同分异构体有很多种,写出同时符合下列条件的所有同分异构体的结构简式_____________。
①含有苯环 ②核磁共振氢谱有三个峰
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+基态核外电子排布式为 ;[Cu(NH3)4]SO4·H2O中,与Cu2+形成配位键的原子是 (填元素符号)。
(2)乙醇分子中O原子轨道杂化类型为 。与NH3互为等电子体的一种阳离子为 (填化学式)。
(3)N、O、S第一电离能由大到小的顺序为 。
(4)某含有结晶水的铜的氯化物的晶胞结构如右图所示,该化合物的化学式是 。
为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量。
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染。
已知:CH4(g) + 2NO2(g)=N2(g) +CO2(g) + 2H2O(g) △H=-867.0 kJ/mol
NO2(g)= N2O4(g) △H=-28.5 kJ/mol
N2O4(g) △H=-28.5 kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中,发生NO2(g)+SO2(g) SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
(3)如图1是一种用NH3、O2脱除烟气中NO的原理,该原理中NO最终转化为H2O和 (填化学式),当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为 L。
(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。有人利用图2所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95 % 以HCO3-存在),有利于减少环境中温室气体含量。
①a室的电极反应式为 。
②b室中提取CO2的反应的离子方程式为 。
③b室排出的海水(pH<6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海。处理的方法是 。
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其它性质 |
| SO2Cl2 |
-54.1 |
69.1 |
①易水解,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 |
10.4 |
338 |
吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题: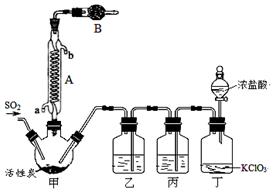
(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。