现有室温下的四种溶液,有关叙述不正确的是
| 编号 |
① |
② |
③ |
④ |
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
A.相同体积的③、④溶液分别与NaOH完全反应,消耗NaOH的物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中:c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.Va L④溶液与Vb L②溶液混合[近似认为混合溶液体积=(Va+Vb)L],若混合后溶液的pH=4,则Va∶Vb=11∶9
如果ag某气体中含有的分子数为b,则cg该气体在标准状况下占有的体积应表示为(式中NA为阿伏加德罗常数)( )
A.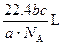 |
B. |
C.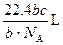 |
D.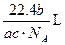 |
下列关于混合物分离的方法中,能够分离KNO3和NaCl的是( )
| A.溶解过滤 | B.结晶 | C.蒸馏 | D.萃取 |
有下列仪器:①烧杯;②蒸发皿;③平底烧瓶;④试管;⑤坩埚;⑥锥形瓶。其
中可以用酒精灯直接加热的仪器是( )
| A.①②④⑤⑥ | B.②④⑤ | C.①③⑥ | D.④⑥ |
某实验小组只领取下列仪器或用品:铁架台、铁圈、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。只应用上述仪器或用品,不能进行的实验操作是( )
| A.蒸发 | B.萃取 | C.过滤 | D.蒸馏 |
下列离子检验的方法正确的是( )
A.某溶液 生产白色沉淀,说明原溶液中有Cl- 生产白色沉淀,说明原溶液中有Cl- |
B.某溶液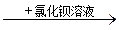 生产白色沉淀,说明原溶液中有SO42- 生产白色沉淀,说明原溶液中有SO42- |
C.某溶液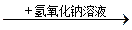 生产蓝色沉淀,说明原溶液中有Cu2+ 生产蓝色沉淀,说明原溶液中有Cu2+ |
D.某溶液 生成无色气体,说明原溶液中有CO32- 生成无色气体,说明原溶液中有CO32- |