某温度(t ℃)时,水的离子积为KW=1.0×10-13,则该温度(填“大于”、“小于”或“等于”)________25 ℃,其理由是
____________________________________________________________。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是___________________________________。
(2)若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是__________________________________________。
现有X、Y、Z、M四种元素均为短周期元素。有关信息如下表:
| 原子或分子结构、单质或化合物相关信息 |
|
| X |
含X元素的物质焰颜色反应为黄色 |
| Y |
单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得Y的单质 |
| Z |
Z元素原子易失去2个电子形成8电子结构的离子 |
| M |
M元素原子的最外层电子数是K层电子数的3倍,M与X处于同一周期 |
(1)X元素在周期表的位置是;
(2)1个Y单质分子中含对个共用电子对;
(3)Z能在CO2气体中燃烧,其化学反应方程式为。
(4)化合物X2M溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质X2M2,其溶液显黄色.则X2M2的电子式为,用化学方程式表示X2M溶液在空气中的变质过程.
香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得: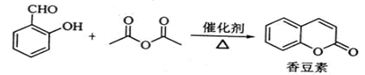
以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)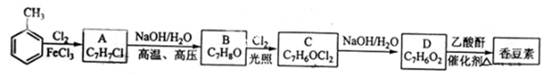
已知以下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的化学名称为__________;
(2)香豆素的分子式为_______;由甲苯生成A的反应类型为___________;
(3)B的同分异构体中含有苯环的还有_____种,其中在核磁共振氢谱中只出现四组峰的有_____种;
(4)由B生成C的化学反应方程式为___________;
(5)D的同分异构体中含有苯环的还有______种,其中:既能发生银境反应,又能发生水解反应的是________(写结构简式)。
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。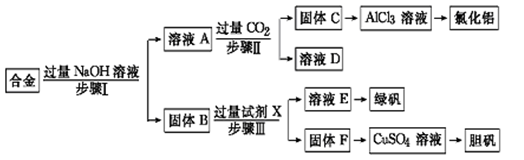
请回答:
(1)写出步骤Ⅰ反应的离子方程式:。
(2)试剂X是。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是。
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是。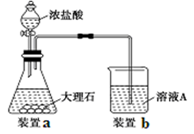
(4)用固体F制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式,请选出你认为的最佳途径并说明选择的理由。
(9分) 在下列物质转化中,已知A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系: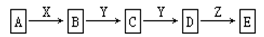
说明:当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。(已知H2CO3、H2S、H2SO3、H2SiO3皆为二元弱酸)
请回答下列问题:
(1)A是,Y是,Z是(填化学式,下同)。
(2)当X是强酸时,E是,写出B生成C的化学方程式: _____ 。
(3)当X是强碱时,E是,写出D生成E的离子方程式: _____。
(9分) 向浓度相等、体积均为50 mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100 mL。
(1)在KOH溶液中通入一定量的SO2气体后,溶液中溶质的组成可能是:
①; ②;
③; ④。
(2)在稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生SO2的体积(标准状况)与所加盐酸的体积关系如下图所示。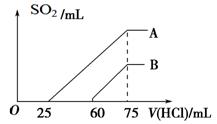
①A曲线表明,原溶液通入SO2气体后,所得溶质与盐酸反应产生SO2的最大体积是____mL(标准状况)。
②B曲线表明,原溶液通入SO2气体后,所得溶液中溶质的化学式为_________________。
③原KOH溶液的物质的量浓度为________ ____。