氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中正确的是
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(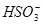 )>c(
)>c(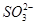 )>c(OH-)
)>c(OH-)
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是
| A.4>2>1>3 | B.2>1>3>4 | C.4>2>3>1 | D.3>2>4>1 |

室温下,在pH =0溶液中,下列各组离子中能大量共存的是
| A.SO42-、NO3-、CO32-、K+ | B.Al3+、NH4+、K+、SO42- |
| C.Al3+、Na+、S2-、SO42- | D.Fe2+、Ca2+、H+、NO3- |
用3g块状大理石与30mL3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是:①再加入30mL3mol/L 盐酸 ②改用30mL6mol/L盐酸③改用3g粉末状大理石 ④适当升高温度
盐酸 ②改用30mL6mol/L盐酸③改用3g粉末状大理石 ④适当升高温度
| A.①②④ | B.②③④ | C.①③④ | D.①②③ |
一定温度下,对可逆反应A(g)+2B(g)=3C(g)的下列叙述中,能说明反应已达到平衡的是()
| A.A物质与C物质的反应速率之比为1∶2 |
| B.单位时间内消耗a mol A,同时消耗3a mol C |
| C.容器内的压强不再变化 |
| D.混合气体的物质的量不再变化 |
把0.05 mol NaOH分别加入到下列100 mL溶液中,溶液的导电能力变化不大的是( )
| A.自来水 |
| B.0.5 mol·L-1盐酸 |
| C.0.5 mol·L-1醋酸 |
| D.0.5 mol·L-1氢氧化钡 |