某化学兴趣小组为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质: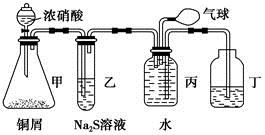
(1)写出甲中反应的离子方程式:_____________________
乙中的现象是__________________________________________________
可证明NO2的氧化性;在丙中鼓入空气后的现象是_____________________________________,可证明NO的还原性。
(2)实验前丙中充满水的作用是________________________________________
(用反应的化学方程式和简要文字回答)。
(3)小华对上述实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是_________________________________________________。
你认为怎样才能准确证明NO2的氧化性?___________________________
(简要回答出原理和现象即可)。
为防止碘缺乏病,通常在食盐中加入KIO3。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程
式是________________________________________,
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液
将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是。
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。
请回答下列问题:
①写出B和C的化学式:B,C。
②滴定时,判断滴定达到终点的现象是。
③KIO3的质量分数是(列出计算式)。
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)
A过滤后未洗涤所得沉淀,直接烘干灼烧
B在敞口容器中用托盘天平称量样品时,操作时间过长
C沉淀灼烧不彻底
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度 线,计算出NaCl固体的体积为VmL。回答下列问题:
线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是_________________________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为a cm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解 | C.结晶法 | D.分液法 E.蒸馏法 F.过滤法 |
⑴从碘的水溶液中提取碘:;
⑵从硝酸钾和氯化钠的混合溶液中获得硝酸钾:;
⑶分离水和油的混合物:;
⑷分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合:。
(12分)同学们课外探究酸的性质活动中将以下8个实验分为三组进行(如下图所示)。
(1)这8个实验是如何分组的?请写出各组的试管编号:
第一组第二组第三组,
你认为如此分组的依据是:。
(2)写出试管②⑤的实验现象及有关的离子方程式:
②; 。
。
⑤;。
(3)请作为课外活动小组成员,根据实验及现象的分析、比较,归纳出的结论(至少答3条):
①_________________________________________________;
②_________________________________________________;
③__________________________________________________。
下图表示配制 220 mL 0.100 mol·L-1 Na2SO4溶液的几个关键实验步骤和操作,据图回答下列问题:
(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是,规格。
(2)步骤B通常称为转移,步骤A通常称为。
(3)将上述实验步骤A→F按实验过程先后次序排列。
(4)下列操作对所配制溶液浓度的影响:
样品溶解后未冷却就直接转移到容量瓶中,并马上进行配制,。
摇匀后,发现凹液面低于刻度线大约1mm, 。(填偏高、偏低、无影响)