FeSO4可发生如图所示的一系列反应,下列说法错误的是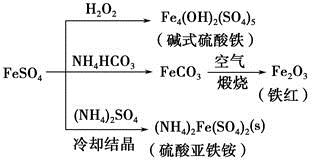
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
下列规律与化学反应的能量变化关系最大的是
| A.阿伏加德罗定律 | B.盖斯定律 | C.勒夏特列原理 | D.欧姆定律 |
120 mL含有2 mol碳酸钠的溶液和200 mL,1.5 mol·L-1盐酸,不管将前者滴加入后者,还是将后者滴加入前者,下列叙述正确的是
| A.Na2CO3溶液中加盐酸,无气体生成 |
| B.盐酸中加入Na2CO3溶液,开始无气体,后有气体生成 |
| C.无论怎么滴加,都有气体生成,且生成的气体一样多 |
| D.无论怎么滴加,都有气体生成,且盐酸中滴加Na2CO3溶液产生的气体多 |
下表中评价合理的是
| 选项 |
化学反应及其离子方程式 |
评价 |
| A |
NaHSO4溶液与Ba(OH)2溶液反应至 SO42-沉淀完全: 2H++SO42-+Ba2++2OH-= BaSO4↓ + 2H2O |
正 确 |
| B |
向碳酸镁溶液中加入足量稀盐酸: CO32-+2H+=CO2↑+H2O |
错误,碳酸镁不应写成离子形式 |
| C |
向沸水中滴加饱和的氯化铁溶液至液体变为红褐色: Fe3++3H2O = Fe(OH)3↓+3H+ |
正 确 |
| D |
NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3- |
正 确 |
下列叙述不正确的是
| A.切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2=Na2O2 |
| B.4.6 g Na与O2完全反应,生成7 g产物时失去电子的物质的量为0.2 mol |
| C.Na与稀硫酸反应的离子方程式为2Na+2H+===2Na++H2↑ |
| D.将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 |
下列氧化还原反应中,水作为氧化剂的是
A.C+H2O CO+H2 CO+H2 |
| B.3NO2+H2O=2HNO3+NO |
| C.2Na2O2+2H2O=4NaOH+O2↑ |
| D.2F2+2H2O=4HF+O2 |