A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 ,D为 。(填元素符号)
(2)D的最高价氧化物的水化物的化学式是 ,E的电子式是 。
(3)写出由A、B组成的化合物与E反应的化学方程式: 。
(4)请用电子式表示出C和D形成的化合物F的形成过程: 。
[化学一选修3:物质结构与性质](15分)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图: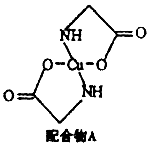
(1)Cu元素基态原子的电子排布式为 ________________。
(2)配合物A中碳原子的轨道杂化类型为________________, 配合物A中不存在( )
A.极性键
B.非极性键
C.氢键
D.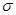 键
键
E.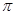 键
键
F.离子键
(3)lmol氨基乙酸钠(H2N-CH2-COONa)含有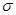 键的数目为_________。
键的数目为_________。
(4)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体且为负一价阴离子:________(写化学式)。
(5)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是________,铜离子的配位数是________。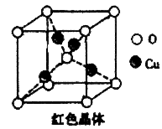
(6)配合物A中元素C、H、N、O组成的化合物CH4和NO,在400~500°C和Pt做催化剂下,能转化成无毒无害的物质,利用该反应可以控制机动车尾气排放。该反应方程式为:________________。
[化学选修——2.化学与技术](15分)碳酸钠是一种重要的化学基本工业产品。比利时人索尔维发明了氨碱法生产碳酸钠,氨碱法生产原理示意图如下:
我国化工专家设计了联合制碱法,联合制碱法生产原理示意图如下: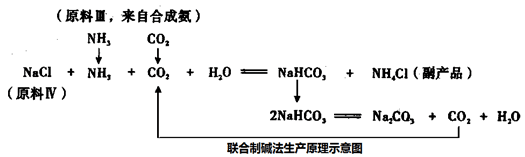
请回答下列问题:
(1)从索尔维制碱法生产原理示意图可知,氨碱法的总反应方程式为 ______________。按照绿色化学原则,理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,实现废弃物的零排放。计算索尔维制碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)______________。
(2)试列举出索尔维制碱法的两大缺点。
①______________;②_____________。
(3)设计联合制碱法的我国化工专家是______________;
(4)从联合制碱法生产原理示意图可知,原料III 中的CO2来自合成氨,指出步骤名称,并写产生CO2化学方程式。
步骤I:__________,化学方程式_________________,
步骤II:__________,化学方程式__________。
(14分)亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2∙12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。
若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4∙FeSO4】溶液后,再与NaClO溶液混合,观察到大试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为______。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。
【化学——选修5:有机化学基础】有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。
请回答:
(1)B中所含官能团的名称为 ;D的分子式为 ;
(2)Ⅲ的反应类型为 (填字母序号);
a.还原反应b.加成反应c.氧化反应d.消去反应
(3)写出下列反应的化学方程式:
Ⅰ: ;
Ⅱ: ;
(4)C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为 ;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个—CH3,它们的结构简式为 和 ;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为 。
【化学——选修3:物质结构与性质】A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。回答下列问题:
(1)D原子的核外电子排布式为 ,E的价层电子轨道示图为______________。
(2)单质B有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;
(3)A、B、C中第一电离能最大的是________(填元素符号),其中A的氢化物(AH3)分子中,A原子轨道的杂化类型是 。
(4)化合物D2B的立体构型为 ,单质D与湿润的Na2CO3反应可制备D2B,其化学方程式为 .
(5)E与C所形成化合物晶体的晶胞如图所示。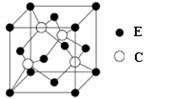
①在1个晶胞中,E离子的数目为 。
②该化合物的化学式为 。