电石中的碳化钙和水能完全反应: CaC2+2H2O=C2H2↑+Ca(OH)2,使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量。
(1)若用下列仪器和导管组装实验装置: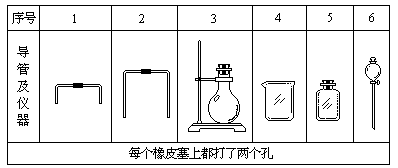
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是:( )接( )接( )接( )接( )接( )。
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体时,关闭活塞。
正确的操作顺序(用操作编号填写)是 。
(3)若实验产生的气体有难闻的臭鸡蛋这是因为含有 杂质。检验此杂质的反应为 。
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数是 %。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。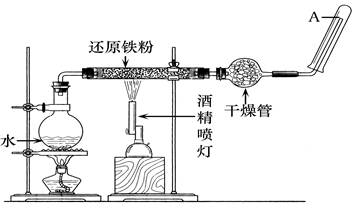
请回答该实验中的问题。
(1)写出该反应的化学方程式。
(2)实验前必须对整套装置进行的操作是。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是。
(4)干燥管中盛装的物质可以是,作用是。
(5)试管中收集到的气体是,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行,这一操作的目的是 。
如下两个反应: A、NaOH+HCl=NaCl+H2O B、2FeCl3+Fe=3FeCl2
(1)根据两反应本质,分别判断能否用于设计原电池____________________________。其理由_________________________________________________________。
(2)如果可以,请画出实验装置图,注明电解质溶液名称和正负极材料,标出电子的流动方向,写出电极反应式。

________是正极,正极反应式:___________________;
________是负极,负极反应式:__________________。
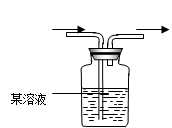
证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是。
(2)B中溶液发生反应的离子方程式是。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是
。
(4)过程Ⅲ实验的目的是。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐,得电子能力逐渐______。
考查知识点:卤素单质氧化性强弱的比较,对应实验原理、操作、现象的描述,从结构上理解氧化性递变的原因。
1,2,3,4—四氢化萘的结构简式如下图, 分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+ 4Br2→ C10H8Br4+ 4HBr生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:

①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。
②慢慢滴入液溴,不断搅拌,直到反应完全。
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。
④ 分液,得到的“水层”即氢溴酸溶液。
回答下列问题:
(1) 如图所示的装置, 适合步骤①和②的操作的是。
(2) 步骤②中如何判断“反应完全”_________________________________________。
(3) 步骤③中补充少量四氢化萘的目的是。
(4) 步骤③中过滤后得到的固体物质是_____________________。
(5) 已知在实验条件下,饱和氢溴酸溶液中氢溴酸的质量分数是66%,如果溴化反应进行完全,则步骤①中水和四氢化萘的质量比约是1:____________(保留小数点后1位)。
实验室制备气体是中学生必做实验,一般地,要得到纯净、干燥气体的装置流程是:发生装置—净化装置—干燥装置---收集装置---尾气处理装置(假设需要)
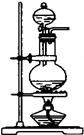
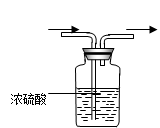
发生装置A发生装置B净化装置C干燥装置D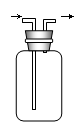
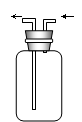
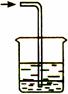
收集装置E收集装置F(可用于收集H2等气体)尾气处理装置G
某研究性化学学习小组现需要若干瓶CO2、O2和Cl2,回答下列问题:
(A)有关发生装置和净化装置
(i) 一般地,依据反应物的状态和反应条件选择所需装置,上述两种发生装置适用于反应物是固体+液体,生成气体的速度可通过操作分液漏斗来控制。
(ii) 如果从发生装置中出来的气体含有杂质(除水蒸汽外),要想得到纯净气体,则必须选择此装置净化,达到除杂的目的。
(1)、 要使生成气体的速度平缓,如何操作分液漏斗使液体顺利流下?_________________。
(2)、若用大理石和稀盐酸制备CO2,因盐酸挥发,使CO2混有HCl杂质,必需选用上述净化装置C除去,装置C中应装___________________溶液。
(3)、若制备O2,反应物是Na2O2和H2O,你选择上述发生装置中的________________,化学方程式是_____________________________________________________。
(4)、若制备Cl2,反应物是MnO2和浓HCl,你选择上述发生装置中的________________,化学方程式是_______________________________________________,想得到纯净、干燥的Cl2是否需要净化装置?为什么?__________________________________________________。
(B)有关收集装置
(i) 不与空气反应,且密度比空气重的气体可用向上排空气法。
(ii) 不与空气反应,且密度比空气轻的气体可用向下排空气法。
(iii) 难溶于水的气体可用排水法。
(5)、上述三种气体可用收集装置中的E装置收集的有________________。
(C)有关尾气处理:对大气产生污染的有毒气体在实验室制备时都要进行尾气处理,
(6)、多余Cl2必须处理,尾气处理装置中盛装的溶液应是____(选填“H2O” 、“NaOH”或 “浓H2SO4”)。