下列过程的离子方程式正确的是
| A.用烧碱溶液吸收Cl2:Cl2+2OH- =Cl-+ClO-+H2O |
| B.用饱和Na2CO3溶液转化锅垢中的CaSO4:CaSO4(s)+CO32- (aq)=CaCO3(s)+SO42-(aq) |
| C.实验室制备Fe(OH)3胶体:Fe3+ +3OH- =Fe(OH)3↓ |
| D.金属Na与水反应:Na +2H+ = H2↑+Na+ |
在一定条件下,将体积比为2:1的SO2和O2混合,发生反应:2SO2+O2 2SO3,平衡时O2占混合气体的体积分数为20%,则SO2的转化率是()
2SO3,平衡时O2占混合气体的体积分数为20%,则SO2的转化率是()
| A.20% | B.40% | C.50% | D.60% |
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)l moI化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示。
现提供以下化学键的键能:P—P198kJ·mol-1。P—O 360kJ·mol-1、氧气分子内氧原子间的键能为,498Kj·mol-1。则P4+3O2 =P4O6的反应热△H为()
| A.+1638kJ·mol-1 | B.-1638kJ·mol-1 | C.-126kJ·mol-1 | D.+126kJ·mol-1 |
以NA表示阿伏加德罗常数,下列说法正确的是()
| A.T℃时,1LpH=6纯水中,合10-6NA个OH- |
| B.15.6gNa2O2与过量CO2反应时,转移的电子数为0.4NA |
| C.1mol C9H20中含有9mol C—C单键 |
| D.1 mol·L-1的Na2CO3溶液中CO32-离子数目一定小于NA |
现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。甲、乙两元素相比较,不能验证金属性甲元素比乙元素较弱结论的实验是()
| A.将在空气中放置已久的这两种元素的块状单质分别放入热的NaOH溶液中 |
| B.将这两种元素的单质粉末分别和同浓度的足量的盐酸反应 |
| C.将这两种元素的单质粉末分别和热水作用,并滴入酚酸溶液 |
| D.比较这两种元素的气态氢化物的稳定性 |
将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。用数轴表示的下列化学知识中不正确的是()
A.常温条件下,酚酞的变色范围: |
B.分散系的分类: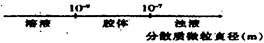 |
C.AlCl3和NaOH溶液反应后铝元素的存在形式: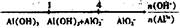 |
D.CO2与NaOH溶 液反应的产物: 液反应的产物: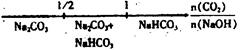 |