[实验化学]
2-苯基-2-丁醇是重要的有机合成中间体,以溴苯为原料合成该中间体的反应原理如下: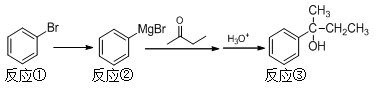
【实验装置】
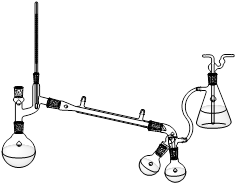
装置Ⅰ 装置Ⅱ
【实验步骤】
步骤1:将镁条置于装置Ⅰ的三颈烧瓶中,加入100 mL乙醚(ρ=0.71g·cm-3),在冷却条件下缓缓滴入溴苯,微热并加入一小块碘引发反应①。
步骤2:滴加14.2 mL丁酮和30 mL乙醚混合物,发生反应②;滴加入20%的NH4Cl水溶液,发生反应③。
步骤3:分出油层,用水洗涤至中性,用无水CaCl2干燥。
步骤4:用装置Ⅱ先蒸出乙醚,再蒸馏出产品。
(1)步骤1中加入碘的作用是 。
(2)装置Ⅰ中滴加液体所用的仪器的名称是 ,反应②需将三颈烧瓶置于冰水中,且逐滴加入丁酮和乙醚,其目的是 。
(3)步骤三中分离出油层的具体实验操作是 。
(4)装置Ⅱ采用的是减压蒸馏,实验时需将吸滤瓶需连接 ;采用这种蒸馏方式的原因是 。
(10分)某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol•L﹣1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L﹣1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液.
氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____________式滴定管,可使用的指示剂为____________。
(3)样品中氨的质量分数表达式为_____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将__________(填“偏高”或“偏低”)。
(5)测定氯过程中,使用棕色滴定管的原因是_________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol•L﹣1,c(CrO42-)为__________mol•L-1。已知:Ksp(Ag2CrO4)=1.12×10-12
(6)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,钴的化合价__________,制备X的化学方程式为__________;X的制备过程中温度不能过高的原因是__________。
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。探究二氧化硫的制取和性质都有着非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-1价)在高温下和氧气反应制备SO2:
4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
该反应中被氧化的元素是__________(填元素符号)。当该反应转移5.50mol电子时,生成的二氧化硫在标准状况下的体积为__________L。
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,如果能控制反应速度,下图中可选用的发生装置是_________(填写字母)。
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有25.2%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠___________g(保留一位小数)。
(3)某化学兴趣小组设计用如图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为__________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成
上述方案中合理的是_________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为________。
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取盐酸体积/mL |
应选用容量瓶的规格/mL |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2—3cm处
(3)溶液注入容量瓶前需恢复到室温,这是因为______________________。
(4)若注入容量瓶前未恢复到室温,对所配溶液浓度将有何影响? _______________(填“偏低”“偏高”“无影响”)
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
Ⅰ.把氯气通入紫色石蕊溶液中,可以观察到的现象是:
请你解释其中的原因_________________________________
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
(1)其反应原理为:(用化学方程式表示)__________________________
(2)实验室配制好4.0 mol·L-1的NaOH溶液,这种溶液___________L才能与2.24 L氯气(标准状况)恰好完全反应。
(3)配制500 mL 4.0 mol·L-1 NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1 cm~2 cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切。
①所需称量的氢氧化钠固体的质量是__________________。
②上述步骤的正确操作顺序是________________________。
③上述实验需要的仪器有____________________________。
④某同学观察液面的情况如图所示,对所配溶液的物质的量浓度有何影响? _______________(填“偏高”、“偏低”或“无影响”);
⑤在配制溶液的过程中,下列操作能造成结果偏低的是___________。
| A.容量瓶不干燥,含有少量蒸馏水 |
| B.溶解所用烧杯未洗涤 |
| C.NaOH溶解后,未冷却即进行实验 |
| D.定容后摇匀,发现液面低于刻度线 |
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
| A.品红溶液 | B.紫色石蕊溶液 | C.酸性KMnO4溶液 | D.溴水 |
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
(5)下图是将过程②产生的气体SO2转化为重要的化工原料H2SO4的原理示意图,若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2SO4的质量比为___________________。