某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度。下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
(1)该实验应选用 作指示剂。
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。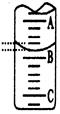
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不用化简):C1= mol/L。
(共12分)
(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g) pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
①该反应的平衡常数表达式为(各物质浓度的指数用数值表示):。
②若充入A,K值(填一定增大、一定减小、或可能增大也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件下,根据图示回答下列问题:在0~15min内的平均反应速率:v(B)=
(2)对于某可逆反应:A(g)+B(g) 2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
①写出t2时改变的条件可能是:(用文字表达);
②t4时改交的条件可能是(用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
实验室在1L密闭容器中进行模拟甲醇合成实验:CO(g)+2H2(g) CH3OH(g)。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol·L—1)
CH3OH(g)。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol·L—1)
| 10min |
20min |
30min |
40min |
50min |
60min |
|
| 300℃ |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
| 500℃ |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
①300℃时反应开始10分钟内,H2的平均反应速率为__________。
②500℃时平衡常数K的数值为___________。
③300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母)。
a.c(H2)减小b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,c其主要工艺流程如下: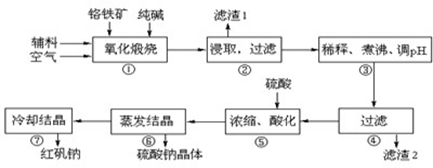
①中涉及的主要反应有:
主反应:4FeO•Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应: SiO2+Na2CO3 Na2SiO3+CO2↑ Al2O3+Na2CO3
Na2SiO3+CO2↑ Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
| 完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
(1) “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ;
(2) “③”中调节pH至4.7,目的是 ;
(3) “⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: ;
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol•L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol•L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:
②若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度
(设整个过程中其它杂质不参与反应)
(12分) 未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。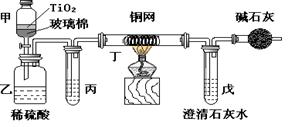
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)甲中反应的离子方程式为__________________________________
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是______(填字母)
a.饱和食盐水 b.饱和NaHCO3溶液 c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是____________________________装有碱石灰的干燥管的作用是____________________________
(4)戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于________请说明该测得值与实际处理的百分率相比偏高还是偏低_________?简要说明可能的原因__________________________________。
(5)请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂)
_________________________________________________________________________
乙二酸(HOOC-COOH)俗名草酸,易溶于水,属于二元中强酸,生产和科学实验中有着广泛的用途。草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定,
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上。 KMnO4 + H2C2O4+ ()---K2SO4 + CO2↑+ MnSO4 + ()
KMnO4 + H2C2O4+ ()---K2SO4 + CO2↑+ MnSO4 + ()
(2)整个实验过程中不需要的仪器有(填序号)。
a.托盘天平(带砝码,镊子)b.酸式滴定管 c.烧瓶
d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙
(3)实验中,标准KMnO4溶液应盛装在____式滴定管中。滴定终点时溶液的
颜色变化为。
(4)在滴定过程中若用去amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为________mol·L-1,由此可计算x的值是___________。
(用含W、a、V的代数式表示)
(5)该小组同学将0.02mol草酸晶体(H2C2O4·2H2O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为