(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式 ;
②写出“联合制碱法”有关反应的化学方程式________________。
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同______________________________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
① 炼钢时,加入硅、锰和铝的目的是_______________________。
② 不锈钢含有的Cr元素是在炼钢过程的氧吹____(填“前”或“后”)加入。
③ 炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。
海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是 。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac + CO + NH3 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
① 0<V≤44.8 L时,电池总反应方程式为。
② 44.8 L<V≤89.6 L时,负极电极反应为。
③ V="67.2" L时,溶液中离子浓度大小关系为。
已知A、B、C、D、E、F六种短周期元素中,A、B、C、D是组成蛋白质的基本元素;A与B的原子序数之和等于C原子核内的质子数;A与E、D与F分别位于同一主族,且F原子核内的质子数是D原子核外电子数的2倍。据此,请回答:
(1)F在周期表中的位置是。
(2)由A、C、D、F按8:2:4:1原子个数比组成的化合物甲中含有的化学键类型为;甲溶液中各离子浓度由大到小的顺序为(用离子浓度符号表示)。
(3)化合物乙由A、C组成且相对分子质量为32;化合物丙由A、D组成且分子内电子总数与乙分子内电子总数相等;乙与丙的反应可用于火箭发射(反应产物不污染大气),则该反应的化学方程式为。
(4)由A、D、E、F组成的化合物丁能与硫酸反应并放出刺激性气味的气体,则丁的化学式为;实验测得丁溶液显弱酸性,由此你能得出的结论是。
(5)由B、A按1:4原子个数比组成的化合物戊与D的常见气态单质及NaOH溶液构成原电池(如图),试分析: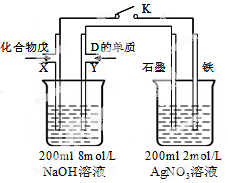
①闭合K,写出左池X电极的反应式;
②闭合K,当X电极消耗1.6g化合物戊时(假设过程中无任何损失),则右池两极共放出气体在标准状况下的体积为升。

提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是,发生反应的离子方程式为 ;在加高锰酸钾溶液前,若pH较低,对除杂的影响是。
(2)反应③的反应类型为,过滤得到的滤渣中,除了过量的锌外还有。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2取干操后的滤饼11.2g,煅烧后可得到产品8.1g,则x等于。
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题:
(1)B中所含元素位于周期表中第周期,族。
(2)A在B中燃烧的现象是。
(3)D+E→B的反应中,被氧化与被还原的物质的物质的量比是。
(4)G+J→M的离子方程式是。
(5)Y受热分解的化学方程式是。
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最处层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为、 、。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有、。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是。此化合物在酸性条件下与高锰酸钾反应的离子方程式为;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为。