A~F均为元素周期表中前四周期元素,其相关信息如下表:
| 元素 |
相 关 信 息 |
| A |
A的基态原子最外层电子排布式为2s22p3 |
| B |
B是地壳中含量最高的元素 |
| C |
C+与B的简单离子的电子层结构相同 |
| D |
D的一种核素的质量数为64,中子数为35 |
| E 、F |
E 、F既同周期又同族,且原子序数F比E多2 |
请回答下列问题:
(1)D的价电子的电子排布式是 ;F原子的原子结构示意图为 。
(2)A、B的第一电离能的大小顺序为 。
(3)AB3-中A原子的杂化轨道类型为_____;与A2B互为等电子体的分子的分子式为 (任写一个即可)。
(4) D晶体的晶胞如图所示为面心立方最密堆积(在晶胞的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为 。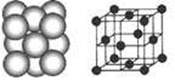
(5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式 。
(6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为 。
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu + 8HNO3 ="=" 3Cu(NO3)2 + 2NO↑+ 4H2O
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)
3Cu + 8HNO3 ="=" 3Cu(NO3)2 + 2NO↑+ 4H2O
(2)上述反应中氧化剂是,氧化产物是(填化学式)。
(3)若19.2g铜与足量硝酸完全反应,则消耗硝酸为mol,被还原的硝酸为mol,生成NO的体积为L(标准状况) 。
(11分)有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E产生沉淀,B与D、B与E产生沉淀,C与E、D与E产生气体,而C与D无反应现象。
由此,可判定各试剂瓶中所盛试剂为(写化学式)
A____________、B____________、C、____________、D____________、E____________。
另外,请写出下面要求的离子方程式:
(1)A与E:_______________________________________________________________。
(2)B与E:_______________________________________________________________。
(3)C与E:____________________________________________________________。
用单线桥表示下列反应
(1)2KClO3==2KCl+3O2↑(2)Zn+H2SO4==ZnSO4+H2↑
在下列反应中:
| A.2F2+2H2O=4HF+O2 | B.2Na+2H2O=2NaOH+H2↑ |
| C.CaO+H2O=Ca(OH)2 | D.2H2O=2H2↑+O2↑ |
(1)水只作氧化剂的是(填序号,下同),
(2)水只作还原剂的是,
(3)水既作氧化剂又作还原剂的是,
(4)水既不作氧化剂又不作还原剂的是。
以下10种物质:①铝线 ②石墨 ③BaSO4 ④纯硫酸 ⑤金刚石
⑥石灰水 ⑦乙醇 ⑧熔融的KNO3 ⑨NH3 ⑩盐酸
其中(1)能导电的是(填序号,下同)
(2)属于电解质的是
(3)属于非电解质的是