工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)写出该可逆反应的化学平衡常数表达式 ;
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,下列说法中,正确的是 (填编号)。
a.若反应速率υ正(O2)=2υ逆(SO3),则可以说明该可逆反应已达到平衡状态
b.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
c.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
d.平衡后升高温度,平衡常数K增大
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| SO2 |
O2 |
SO2 |
O2 |
|||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
6 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
t |
(3)实验1从开始到反应达到化学平衡时,υ(SO2)表示的反应速率为 ;
T1 T2 (选填“>”、“<”或“=”),理由是 。尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
(4)该溶液中c(Na+)与 c(OH-)之比为 。
该溶液中c(OH—)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 (用编号排序)
A.Na2SO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为。D在周期表中位置 。
(2)写出E的电子式:。
(3)A、D两元素形成的化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:。
相对分子质量不超过100的有机物A,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。 A完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。
①其A相对分子质量为。 (结果四舍五入取整数)
经核磁共振检测发现A的图谱如下: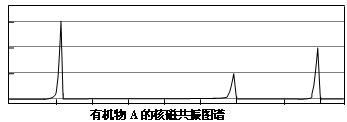
②试写出A的结构简式:____________________________。
③试写出A与甲醇反应生成有机物B的化学反应方程式:。
④B在一定条件下可以反应生成高分子化合物—有机玻璃,写出反应的方程式:。
⑤B的同分异构体有多种,请写出一种和B同类别的同分异构体的结构简式。
在某有机物A的分子中,其结构简式如下图。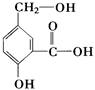
(1)A跟NaOH溶液反应的化学方程式是
(2)A跟NaHCO3溶液反应的化学方程式是
(3)A在一定条件下跟Na反应的化学方程式是:
香草醛结构简式为: ,请按要求完成下列问题:
,请按要求完成下列问题:
(1)香草醛有多种同分异构体,其中苯环上的一溴代物只有两种且属于芳香酸的结构简式___________;
(2)香草醛的同分异构体中属于芳香酯有种。其中某些酯与NaOH作用只能消耗等物质的量的NaOH,写出符合该条件的一种酯在NaOH溶液中水解的化学方程式:。
(3)写出香草醛发生银镜反应的化学方程式:______________________________。
(3分)肉桂醛的结构为: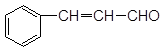
①把足量肉桂醛加入到溴水中,溴水褪色了,这____________(填“能”或“不能”)说明肉桂醛中存在碳碳双键。
②检验分子中碳碳双键的方法是_______________。