如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是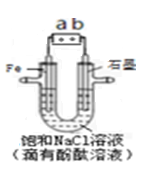
| A.a 为电源的正极 |
| B.通电一段时间后,石墨电极附近溶液先变红 |
| C.Fe电极的电极反应是4OH-- 4e-=2H2O+O2↑ |
D.电解饱和食盐水的总反应是: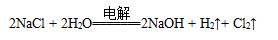 |
在两个恒容容器中有平衡体系:A(g) 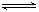 2B(g)和2C(g)
2B(g)和2C(g) 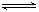 D(g),X1和X2分别是A和C的转化率。在温度不变时,均增加相同的A和C的物质的量,下列判断正确的是
D(g),X1和X2分别是A和C的转化率。在温度不变时,均增加相同的A和C的物质的量,下列判断正确的是
| A.X1降低,X2增大 | B.X1、X2均降低 |
| C.X1增大,X2降低 | D.X1、X2均增大 |
某温度下,4mol NO与定量O2在恒压条件下进行反应,刚开始时气体混合物为2体积,当反应达平衡时,气体混合物占1.5体积,O2为0.5mol。在该温度和压强下,NO转化率为
| A. 50% | B. 60% | C. 75% | D. 80% |
下列各图是温度(或压强)对应2A(s)+2B(g)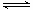 2C(g)+D(g)△H>0的正、逆反应速率的影响,其中正确的是
2C(g)+D(g)△H>0的正、逆反应速率的影响,其中正确的是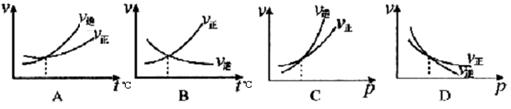
在体积和温度不变的密闭容器中充入1mol H2O蒸气和足量铁粉,建立平衡
3Fe(s)+4H2O(g)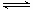 Fe3O4(s)+4H2(g)之后,测得H2O蒸气的分解率为x%,浓度为c1mol/L。若再充人1mol H2O蒸气,建立新的平衡后.又测得H2O蒸气的分解率为y%,浓度为C2 mol/L。则下列关系正确的是
Fe3O4(s)+4H2(g)之后,测得H2O蒸气的分解率为x%,浓度为c1mol/L。若再充人1mol H2O蒸气,建立新的平衡后.又测得H2O蒸气的分解率为y%,浓度为C2 mol/L。则下列关系正确的是
| A.x>y,c1>c2 | B.x<y,c1<c2 | C.x=y,c1 =c2 | D.x=y,c1<c2 |
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
下列说法不正确的是( )
| A.m<n |
| B.Q<0 |
| C.温度不变,压强增大,Y的质量分数减小 |
| D.体积不变,温度升高,平衡向正反应方向移动 |