能正确表示下列反应的离子方程式是
| A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
| B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
| C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ |
| D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
将0.1 mol·L-1的氨水加水稀释至0.01 mol·L-1,稀释过程中温度不变,下列叙述正确的是( )
| A.稀释后溶液中c(H+)和c(OH-)均减小 |
| B.稀释后溶液中c(OH-)变为稀释前的1/10 |
| C.稀释过程中氨水的电离平衡向左移动 |
D.稀释过程中溶液中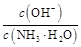 增大 增大 |
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2 HCN+NaNO2,NaCN+HF
HCN+NaNO2,NaCN+HF HCN+NaF,NaNO2+HF
HCN+NaF,NaNO2+HF HNO2+NaF
HNO2+NaF
由此可判断下列叙述不正确的是( )
| A.K(HF)=7.2×10-4 |
| B.K(HNO2)=4.9×10-10 |
| C.根据其中两个反应即可得出结论 |
| D.K(HCN)<K(HNO2)<K(HF) |
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )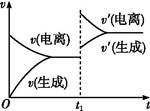
| A.加少量烧碱溶液 | B.升高温度 | C.加少量冰醋酸 | D.加水 |
在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中发生下述反应:PCl3(g)+Cl2(g) PCl5(g),5 min末达到平衡,有关数据如表。
PCl5(g),5 min末达到平衡,有关数据如表。
| PCl3(g) |
Cl2(g) |
PCl5(g) |
|
| 初始浓度(mol·L-1) |
2.0 |
1.0 |
0 |
| 平衡浓度(mol·L-1) |
c1 |
c2 |
0.4 |
下列判断不正确的是( )
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5 min内,v(PCl3)="0.08" mol·L-1·min-1
C.当容器中Cl2为1.2 mol时,可逆反应达到平衡状态
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol·L-1
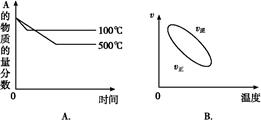
用来表示可逆反应:2A(g)+B(g) 2C(g) ΔH<0 的正确图像是下图中的( )
2C(g) ΔH<0 的正确图像是下图中的( )