已知CH3COOH CH3COO-+H+,下列关于醋酸说法错误的是
CH3COO-+H+,下列关于醋酸说法错误的是
| A.加水稀释,所有离子浓度都减少 |
| B.加入少量固体CH3COONa,平衡向逆方向移动,c(H+)减少 |
| C.升高温度促进了醋酸的电离,Ka增大。 |
| D.醋酸溶液的导电性不一定比盐酸要弱 |
下列说法正确的是
| A.增大压强,使单位体积内活化分子数目增加,化学反应速率一定增大 |
| B.升高温度,使活化分子百分数增加,化学反应速率一定增大 |
| C.活化分子间所发生的分子间的碰撞均为有效碰撞 |
| D.加入反应物,使活化分子百分数增加,化学反应速率一定增大 |
下列装置的线路接通后,经过一段时间,溶液的pH值明显下降的是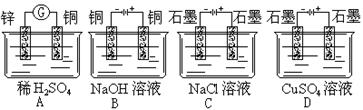
下列有关热化学方程式的叙述正确的是
| A.2H2(g)+O2(g)===2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ |
| B.已知C(石墨,s)="==" C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);△H=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)==2CO2(g);△H1 ;2C(s)+O2(g)="2CO(g)" △H2。则△H1>△H2 |
下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是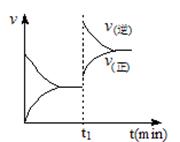
A.2SO2(g)+O2(g)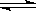 2SO3(g) △H<0 2SO3(g) △H<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0 4NO(g)+6H2O(g) △H<0 |
C.H2(g)+I2(g)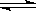 2HI(g) △H>0 2HI(g) △H>0 |
D.C(s)+H2O(g)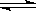 CO(g)+H2(g) △H>0 CO(g)+H2(g) △H>0 |
某温度下,在容积固定的密闭容器中,发生可逆反应中A(g)+2B(g)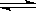 2Q(g)
2Q(g)
平衡时,各物质的浓度比为c(A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q(相当加压),则下列叙述正确的是
A.刚充入时反应速率:v(正)减小,v(逆)增大
B.达到新的平衡时:反应混合物中A.B的体积分数增加
C. 达到新的平衡时:c(A):c(B):c(Q)仍为1:1:2
D. 达到新的平衡过程中:体系压强先增大,后减小