某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是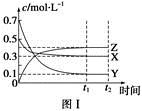
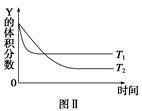
A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0 2Z(g) ΔH>0 |
| B.若其它条件不变,升高温度,正、逆反应速度均增大,X的转化率减小 |
| C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 |
| D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 |
有一瓶14%的氢氧化钾溶液,加热蒸发掉100g水后,得到28%的氢氧化钾溶液80mL,所得溶液的浓度为
| A.5mol/L | B.6mol/L | C.6.25mol/L | D.6.5mol/L |
元素的化学性质主要决定于
| A.相对原子质量 | B.电子层数 |
| C.核电荷数 | D.最外层电子数 |
在下列有关晶体的叙述中错误的是
| A.离子晶体中,一定存在离子键 | B.原子晶体中,只存在共价键 |
C.金属的熔沸点均很高 | D.稀有气体的原子能形成分子晶体 |
下列微粒电子式书写错误的是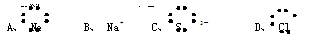
以下分类正确的是
| 单质 |
氧化物 |
酸 |
碱 |
盐 |
|
| A |
HD |
水 |
硫酸 |
烧碱 |
胆矾 |
| B |
黄铜 |
NO2 |
盐酸 |
石灰水 |
FeSO4 |
| C |
碘酒 |
一氧化碳 |
磷酸 |
NH3·H2O |
食盐 |
| D |
H2 |
Fe3O4 |
HNO3 |
纯碱 |
小苏打 |