已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同且恒容的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是( )
| A.Q1=2Q2=92.4 | B.92.4 >Ql>2Q2 | C.92.4=Q1>2Q2 | D.92.4 >Q1=2Q2 |
用自来水养鱼,在将水注入鱼缸之前需把水在阳光下曝晒一段时间,目的是
| A.增加水中含氧量 | B.利用阳光中紫外线杀菌 |
| C.使自来水中少量次氯酸分解 | D.通过日照提高水的温度 |
一氧化碳与氢气在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如图,温度分别为300℃、500℃的密闭容器中,甲醇的物质的量与时间的关系;温度分别为T1~T5的密闭容器中,反应均进行到5min时甲醇的体积分数.下列有关说法正确的是
CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如图,温度分别为300℃、500℃的密闭容器中,甲醇的物质的量与时间的关系;温度分别为T1~T5的密闭容器中,反应均进行到5min时甲醇的体积分数.下列有关说法正确的是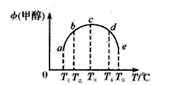
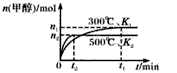
| A.K1 < K2 |
| B.该反应的正反应是气体体积减小的吸热反应 |
| C.将容器c中的平衡态转变到容器d中的平衡态,可采取的措施有升温或减压 |
| D.反应到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动 |
在三个容积相同的容器中进行反应:3M(g)+N(g) 2P(g);△H<0。若起始温度相同分别向三个容器中通入3molM和1mol N,则达到平衡时各容器中P物质的体积分数由大到小的顺序为
2P(g);△H<0。若起始温度相同分别向三个容器中通入3molM和1mol N,则达到平衡时各容器中P物质的体积分数由大到小的顺序为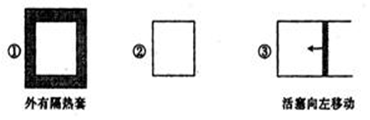
| A.③②① | B.②①③ | C.①②③ | D.③①② |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH- 2CO32—+6H2O, 则下列说法正确的是
2CO32—+6H2O, 则下列说法正确的是
| A.该电池正极和负极是两种活性不同的金属 |
| B.充电时有CH3OH生成的电极为阳极 |
| C.放电时电解质溶液的pH逐渐增大 |
| D.放电时负极反应为:CH3OH-6e-+8OH-=CO32—+ 6H2O |
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |