将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,共产生NO气体4.48 L(标准状况),向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全。则下列有关叙述中不正确的是
| A.开始加入合金的物质的量之和为0.3mol |
| B.反应中被还原和未被还原的硝酸物质的量之比为3∶1 |
| C.沉淀完全时消耗NaOH溶液的体积为200mL |
| D.生成沉淀的质量比原合金的质量增加10.2g |
下列事实与氢键有关的是()
| A.水加热到很高温度都难以分解 |
| B.水结成冰体积膨胀,密度变小 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
D.HF、HCl、HBr、H I的热稳定性依次减弱 I的热稳定性依次减弱 |
下列的叙述中不正确的是( )
| A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强 |
| B.以非极性键结合的分子,不一定是非极性分子 |
| C.判断A2B或AB2型分子是否是极性分子的依据是,具有极性键且分子构型不对称、键角小于180°的非直线型结构 |
| D.非极性分子中,各原子间都应以以非极性键结合 |
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
| A.V形;平面三角形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.直线形;三角锥形 |
下列关于配合物的叙述中,不正确的是 ()
| A.配位化合物中必定存在配位键 |
| B.配位化合物中只有配位键 |
| C.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用 |
| D.[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成配位键 |
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为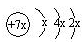 ,b与c形成化合物的电子式
,b与c形成化合物的电子式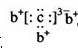 为下列比较中正确的是()
为下列比较中正确的是()
| A.原子半径:a>c>d>b | B.电负性:a>b>d>c |
| C.最高价含氧酸的酸性:c>d>a | D.第一电离能:d>a>b>c |