对于某些离子的检验及结论一定正确的是
| A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42- |
| B.验证烧碱溶液中是否含有Cl﹣,先加稀硝酸除去OH﹣,再加入AgNO3溶液,有白色沉淀,证明有Cl﹣ |
| C.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液中一定有CO32- |
| D.加入氯水后,滴加KSCN溶液,溶液变红,原溶液中一定有Fe2+ |
某溶液中可能含有下列四种离子,加入KSCN溶液后变成红色,则原溶液中一定含有
| A.K+ | B.Al3+ | C.Cl― | D.Fe3+ |
胶体分散系在日常生活中很常见。下列说法正确的是
| A.Fe(OH)3易溶于水形成胶体 |
| B.CuSO4溶液可观察到丁达尔现象 |
| C.Fe(OH)3胶体可观察到丁达尔现象 |
| D.胶体分散系中所有粒子的直径都在1~1000 nm之间 |
某溶液中存在较多的H+、SO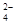 和Cl―,其中还可能大量存在的离子是
和Cl―,其中还可能大量存在的离子是
| A.OH― | B.Ba2+ | C.NH4+ | D.Ag+ |
同分异构现象是造成有机物数目繁多的原因之一。下列物质互为同分异构体的是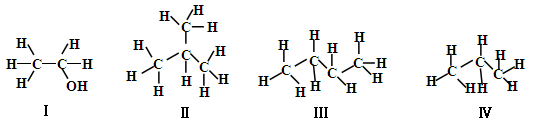
| A.Ⅰ和Ⅱ | B.Ⅱ和Ⅲ | C.Ⅲ和Ⅳ | D.Ⅰ和Ⅳ |
水玻璃是建筑行业常用的粘合剂,并可用于木材防火和防腐处理。水玻璃为
| A.CaSiO3固体 | B.SiO2 |
| C.Na2SiO3水溶液 | D.H2SiO3 |