某溶液能与锌片作用产生H2,则该溶液中可以大量共存的离子组是( )
| A.Na+、NO3-、K+、Fe2+ | B.Fe2+、Na+、SO42-、K+ |
| C.K+、I-、NO3-、H+ | D.NH4+、NO3-、Na+、HCO3- |
下列反应是加聚反应的是 ( )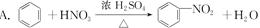
B.CH2=CH2+H2O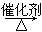 CH3CH2OH
CH3CH2OH
C.(C6H10O5)n+6nO2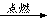 6nCO2+5nH2O
6nCO2+5nH2O
D.nCH2=CCH3CH=CH2
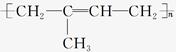
下列有关金属腐蚀的叙述正确的是( )
| A.金属化学腐蚀的实质是M-ne-=Mn+,电子直接由氧化剂提供 |
| B.金属在潮湿的空气中腐蚀的实质是M+nH2O=M(OH)n+n/2H2↑ |
| C.金属的化学腐蚀必须在酸性条件下进行,以析出H2为主 |
| D.在潮湿的强酸性环境下,金属的电化学腐蚀主要以正极上析出H2为主 |
20世纪80年代后,人们发现并证实了碳的另一类单质,它们是由一系列偶数个碳原子构成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关物质X的说法不正确的是( )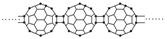
| A.X难溶于水 |
| B.一定条件下X可与H2发生加成反应 |
| C.X的摩尔质量为720n |
| D.X是碳的一种同素异形体 |
工程树脂ABS由CH2=CH—CN(符号A)、CH2=CHCH=CH2(符号B)和(符号S)按一定配比共聚而得。经分析知该ABS样品的组成为CxHyNz(x、y、z为正整数),则原 料中A和B的物质的量之比是 ( )
A.  B.
B.  C.
C.  D.
D. 
下列属于复合材料的是()
| A.钢化玻璃 | B.光导纤维 | C.玻璃钢 | D.氮化硅陶瓷 |