银氨溶液可用于检测CO气体。实验室研究该反应的装置图如下: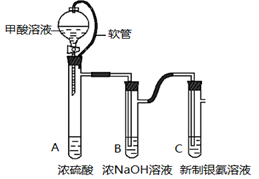
(1)甲酸在浓硫酸条件下能分解生成CO和H2O,体现浓硫酸具有 (填“氧化性”或脱水性)。
(2)软管的作用是 。
(3)浓NaOH溶液的作用是 。
(4)反应结束后试管C底部有黑色沉淀,为验证产物,分离出上层清液和底部黑色固体,并进行实验。
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
d.将黑色沉淀用蒸馏水洗净。
① 实验c的目的是 。
② 根据上述实验现象证明上层清液中含有 。
③ 已知银可溶于浓硝酸,设计实验证明黑色固体是Ag单质:
④ CO与银氨溶液反应中有氨气生成,根据实验现象写出该反应的化学方程式: 。
某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L
| 滴定次数 |
待测液体积(mL) |
标准NaOH溶液读数记录(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
盐卤中除含有Mg2+、Cl-外,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等。从海水提取食盐和Br2后的盐卤中可以提取MgCl2、MgO、Mg(OH)2等物质,制备流程如图所示:
(1)从MgCl2溶液得到MgCl2.6H2O晶体的过程中所需的基本操作顺序依次为_________________ ;
A.加热蒸馏B.加热浓缩C.冷却结晶D.趁热过滤 E.过滤洗涤
(2)制取无水氯化镁必须在氯化氢存在的条件下进行,原因是____________(用适当的文字结合化学用语说明)。
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为_________________ ;加入NaClO的另一个作用是_________________。
(4)Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料.
已知25℃时Ksp[Mg(OH)2]=5.6×10-12,且Mg(OH)2(s)═MgO(s)+H2O(s)△H=+81.5kJ/mol.
①下列叙述正确的是_________
A.从盐卤或海水中获得Mg(OH)2,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂的原因是它分解吸热且生成MgO覆盖可燃物
C.可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
②酸碱指示剂百里酚蓝变色的pH范围如下:
| pH |
<8.0 |
8.0~9.6 |
>9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,在Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为______。
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;②PCl3遇水会强烈水解生 成 H3PO3和HC1;③PCl3遇O2会生成P0Cl3,P0Cl3溶于PCl3;④PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为______________;
(2)F中碱石灰的作用是_____________、_________________________;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是______________;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后.通过_________填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为______________;
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定
③重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为_________。
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
| 资料卡片 |
||
| 物质 |
熔点 |
沸点 |
| SiCl4 |
-70℃ |
57.6℃ |
| TiCl4 |
-25℃ |
136.5℃ |
①据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是_____;分离二者所采取的操作名称是____。
②Ⅲ中反应的化学方程式是________。
③如在实验室中完成步骤IV,应将TiO2•xH2O放在_____(填字母序号图 1)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的__________(填“氧化性”或“还原性”)。
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO的转化率为________。
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是________。
中国沿海某城市采用反渗透法将海水淡化,得到淡水供市民使用,剩余母液继续加工获得其他产品。母液中主要含有Cl-、Na+、K+、Ca2+、SO42-、Br-等离子。某实验小组同学模拟工业生产流程,进行如下实验.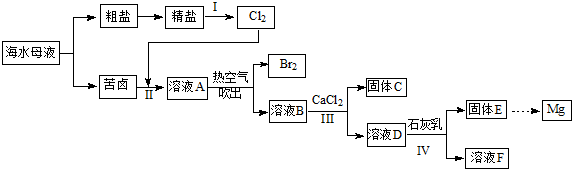
(1)写出实验室制备氯气的化学方程式_____________________;
(2)海水淡化的方法还有____________(写出一种);
(3)I中,电解饱和食盐水的工业生产叫做氯碱工业,写出该反应的离子方程式__________;
(4)Cl2和Br2均为双原子分子,从原子结构的角度解释其原因_____________________;
(5)Ⅲ中,加入适量CaCl2固体的目的是_____________________;
(6)写出IV中反应的离子方程式_____________________;
(7)与过程II类似,工业上常用“空气吹出法”实现海水提溴,将1m3海水浓缩至1L,使用该法最终得到36g Br2,若提取率为60%,则原海水中溴的浓度为__________ mg/L。