硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示: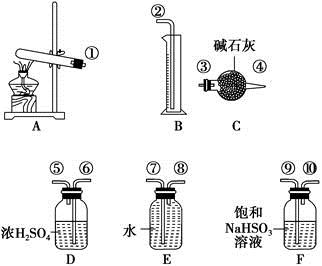
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有 两种;
Ⅲ.所得气体的成分可能含有 三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→ → → → →②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想 正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
| 实验小组 |
称取CuSO4的质量/g |
装置C增加的质量/g |
量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 |
6.4 |
2.56 |
448 |
| 二 |
6.4 |
2.56 |
224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组: ;
第二小组: 。
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
[实验一]用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。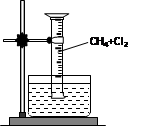
(1)该反应的化学方程式为;(只写第二步)
(2)水槽中盛放的液体最好为;(填标号)
| A.水 | B.饱和石灰水 | C.饱和食盐水 | D.饱和NaHCO3溶液 |
[实验二]用排蒸馏水法收集一试管甲烷和氯气的混合气体,光照反应后,
滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(3)该实验设计的错误之处;
[实验三]
步骤一:收集半试管氯气,加入10 mL 蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH = 3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL 蒸馏水,充分振荡,测得pH = 1.00。
(4)判断该反应中有氯化氢生成的依据是;
(5)假设氯气完全参与反应,且不考虑氯气溶解于水。往反应后的溶液中加水稀释到100.00 mL,取20.00 mL稀释液,加入10.00 mL浓度为0.01 mol·L-1的AgNO3溶液恰好完全反应,则试管中原有氯气在标准状况下的体积为mL;
某研究小组对铁生锈进行研究: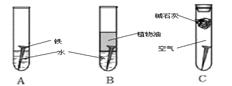
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是(填字母);
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为:;
(3)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(4)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下: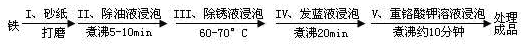
为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
控制变量法是研究化学变化量的重要思想方法。请仔细观察下表中50mL
稀盐酸和1g碳酸钙反应的实验数据:
| 实验 序号 |
碳酸钙 状态 |
C(HCl)/ mol·l-1 |
溶液温度/℃ |
碳酸钙消失 时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
块状 |
0.5 |
20 |
39 |
400 |
| 2 |
粉末 |
0.5 |
20 |
40 |
60 |
| 3 |
块状 |
0.6 |
20 |
41 |
280 |
| 4 |
粉末 |
0.8 |
20 |
40 |
30 |
| 5 |
块状 |
1.0 |
20 |
40 |
120 |
| 6 |
块状 |
1.0 |
30 |
50 |
40 |
(1)该反应属于反应(填“吸热”或“放热”)。
(2)实验5、6表明对反应速率的影响。
(3)从本实验数据中分析,影响化学反应速率的因素还有,能表明这
一规律的实验序号是。
(6分,每空格2分)维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在其弱酸性溶液中用I2溶液进行滴定。
该反应的化学方程式为:C6H8O6+I2=C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下:
①取10mL6mol·L-1CH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。
②准确称取0.2000g样品,溶解于上述冷却的溶液中,并加入1mL淀粉指示剂。
③随后,立即用浓度为0.0500 mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
①煮沸的原因
②冷却后才能使用的原因
(2)经过计算,样品中维生素C的百分含量为
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。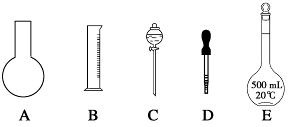
(2)下列操作中,容量瓶所不具备的功能有________(填序号)。
| A.配制一定体积准确浓度的标准溶液 |
| B.贮存溶液 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.准确稀释某一浓度的溶液 |
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol/L(填“大于”、“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是___________________________________________。