关于下列各实验装置图的叙述中,正确的是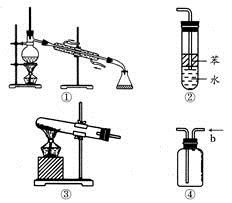
| A.装置①可用于分离沸点不同且互溶的液体混合物 |
| B.装置②可用于吸收HCl气体,并防止倒吸 |
| C.以NH4Cl为原料,装置③可用于实验室制备少量的NH3 |
| D.装置④中从b口进气可用排水法收集NO2、CO等气体 |
主族元素X在周期表中位于第二周期,其原子最外层电子数大于4,元素Y在周期表中位于第三周期,其原子最外层电子数小于4,有关其说法正确的是()
| A.X所形成的单质都是双原子分子 |
| B.原子半径X>Y |
| C.X、Y能形成的阴、阳离子数之比为1:2离子化合物,其一定为碱性氧化物 |
| D.由X、Y组成的某化合物与水反应能生成一种强碱和一种弱碱,其简单离子半径:X>Y |
美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝化合物的推测不正确的是
| A.氢铝化合物与水反应生成氢氧化铝和氢气 |
| B.与H2O反应生成2.24 LH2(标况下),转移的电子为0.2 mol |
| C.氢铝化合物中氢显-1价 |
| D.氢铝化合物具有强还原性 |
下列有关说法正确的是
| A.原子最外层电子数为2的元素一定是ⅡA元素 |
| B.第三周期元素对应的离子半径从左往右依次减小 |
| C.第ⅦA族元素从上到下,其氢化物的酸性逐渐减弱 |
| D.第三周期的主族元素的最高正价一定等于其最外层电子数 |
铍及其化合物的性质与铝十分相似,下列关于铍及其化合物的推断正确的是
| A.铍能与强酸、强碱溶液发生反应 | B.氢氧化铍可溶于水 |
| C.氯化铍溶液显中性 | D.氧化铍的化学式Be2O3 |
已知A、B、C、X是四种中学化学中常见的物质,其转化关系符合下图。则A和X(要求A和X能互换)不可能是
A.C和O2
B.SO2和NaOH溶液
C.Cl2和Fe
D.AlCl3溶液和NaOH溶液