元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用。请回答下列问题:
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为 ,N—N键的键角为 。
(2)基态砷原子的最外层电子排布式为 。
(3)电负性是用来表示两个不同原子形成化学键时吸引键合电子能力的相对强弱,是元素的原子在分子中吸引共用电子对的能力。由此判断N、P、As、Sb的电负性从大到小的顺序是 。
(4)联氨(N2H4)可以表示为H2N—NH2,其中氮原子采用的轨道杂化方式为 ,联氨的碱性比氨的碱性 (填“强”或“弱”),其原因是 。
写出N2H4与N2O4反应的化学方程式: 。
(5)元素X与N同周期,且X的原子半径是该周期主族元素原子半径中最小的,X与Ca形成的化合物CaX2的晶胞结构如图所示:
CaX2的晶体类型是 ,一个晶胞中含有Ca的离子数为 ,含有X的离子数为 。
离子反应方程式书写:(注意写化学方程式不给分)
(1)用盐酸中和烧碱,请写出其反应的离子方程式:。
(2)用稀硫酸清洗铁锈(Fe2O3),请写出其反应的离子方程式:。
(3)用足量的澄清石灰水检验二氧化碳,请写出其反应的离子方程式:。
(4)用铝片与硝酸汞溶液反应,请写出其反应的离子方程式:。
(5)用醋酸可以溶解碳酸钙,请写出其反应的离子方程式:。
(16分)Ⅰ:中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+ 3H2
CO+ 3H2
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
Ⅱ: 甲醇是一种可再生能源,具有广泛的开发和应用前景。
(3)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
②已知反应Ⅰ的能量变化如图所示:由表中数据判断 ΔH10 (填“>”、“=”或“<”)。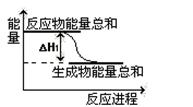
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L, 则CO的转化率为。
(4)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
①该电池正极的电极反应为____________
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为____________.
Ⅰ:有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上可通过下列合成方法制得: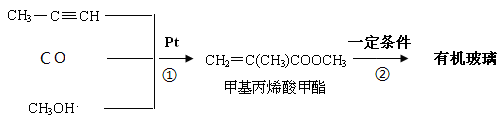
请回答:
(1)反应 ① 的原子利用率是。
(2)反应 ② 的化学方程式是。
(3)有机玻璃分子中的链节是。
Ⅱ:甲基丙烯酸甲酯旧法合成的反应是: ① (CH3)2C=O + HCN (CH3)2C(OH)CN
① (CH3)2C=O + HCN (CH3)2C(OH)CN ② (CH3)2C(OH)CN + CH3OH + H2SO4 CH2=C(CH3)COOCH3 + NH4HSO4
② (CH3)2C(OH)CN + CH3OH + H2SO4 CH2=C(CH3)COOCH3 + NH4HSO4
(1)该方法的缺点是(填字母)
A.反应的原料利用率低 B.原料中有有毒物质 C.对设备腐蚀性较大 D.生产成本高
(2)甲基丙烯酸甲酯可进行的反应有(填字母)
A. 加成反应 B. 氧化反应 C. 取代反应 D. 酯化反应
Ⅲ:将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有浓硫酸的洗气瓶和碱石灰的干燥管,测得洗气瓶的质量增加了2.16 g,干燥管的质量增加了9.24 g,已知该有机物的相对分子质量为108。
(1)该有机物的分子式。
(2)已知该物质中含有苯环,且1mol该物质与金属钠反应后生产标准状况下氢气0.5mol,满足该条件的同分异构有种,写出其中苯环上一溴取代同分异构种类最少的该有机物的结构简式。
(16分)Ⅰ: A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W 同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为。
(2)由A、B、W三种元素组成的18电子微粒的电子式为。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是(标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为。
Ⅱ:X、Y、Z为三种不同短周期非金属元素的单质。在一定条件下发生如下反应: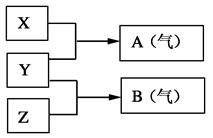
(6)若常温下X、Y、Z均为气体,且A和B化合生成一种固体时的现象是有白烟,则:
Y的化学式是;生成固体的电子式为 。
(7)若常温下Y为固体,X、Z为气体,A 在空气中充分燃烧可生成B,B具有漂白性,则:将B与氯气的水溶液充分反应可生成两种强酸,该反应的化学方程式为_______________________________。
为确定某卤代烃分子中所含卤原子的种类,可按下列步骤进行实验:
a.取少量该卤代烃液体;b.加入适量NaOH溶液,加热;c.冷却后加入稀硝酸酸化;d.加入AgNO3溶液,观察反应现象。回答下列问题:
(1)①步骤b的目的是_______________________________________________;
②步骤c的目的是_______________________________________________。
(2)若加入AgNO3溶液时产生的沉淀为浅黄色,则此卤代烃中的卤素原子是____(填元素符号)。
(3)能否向该卤代烃中直接加AgNO3溶液确定卤素原子的种类?为什么?