X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质。回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是 。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是 。
(3)X与Z中电负性较大的是 。Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为 ,此离子中所含化学键的类型是 ,X—Z—X的键角 109°28′(填“>”、“<”或“=”,已知:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力)。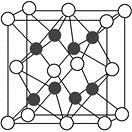 (4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为 ,与一个X离子距离最近的所有的Y离子为顶点的几何体为 。该化合物与MgO相比,熔点较高的是 。
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为 ,与一个X离子距离最近的所有的Y离子为顶点的几何体为 。该化合物与MgO相比,熔点较高的是 。
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为 g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
分,每空有四瓶失去标签的溶液A、B、C、D,它们可能分别是硫酸、盐酸、碳酸钠和硝酸钾溶液中的某一种。各取少量分别放入四支试管里,先向各试管中滴加BaCl2溶液,则A、B有白色沉淀,C、D无明显现象,再向A、B白色沉淀中加入稀硝酸,则A试管中白色沉淀溶解,并有无色气体产生,B试管无变化。另取C、D各少量,分别加入AgNO3溶液,则C试管有白色沉淀,D试管无变化。由此判断:(填化学式)
A. B. C. D.
(Ⅰ)在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4 g。
(1)CO的质量为______________g。
(2)CO的体积为______________L。
(3)混合气体的平均摩尔质量为____________g·mol-1。
(4)混合气体的密度为____________g·L-1。(小数点后保留1位)
(Ⅱ)现要配制1 mol·L-1 Na2CO3溶液250mL,求:
①需要固体Na2CO3____________g;
②需要含结晶水的碳酸钠晶体(Na2CO3·10H2O)____________g;
③需要物质的量浓度为4 mol·L-1的Na2CO3溶液____________mL;
某温度(T ℃)下的溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
(1)此温度下,水的离子积Kw为______________,则该温度T_____________25(填“>”、“<或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则a=_____________________,实验②中由水电离产生的c(OH-)=________________mol·L-1。
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 |
乙 |
丙 |
丁 |
|
| 0.1 mol·L-1 Ba(OH)2溶液体积/mL |
10 |
10 |
10 |
10 |
| 0.1 mol·L-1 NaHSO4溶液体积/mL |
5 |
10 |
15 |
20 |
①按丁方式混合后,所得溶液显________________(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后,反应的离子方程式:_________________________。
③按甲方式混合后,所得溶液的pH为______________________。
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.7×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__________________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为____________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
E.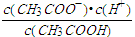
若该溶液升高温度,上述5种表达式的数据增大的是___________________。
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示。
则相同条件下HX的电离平衡常数__________________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是____________________,稀释后,HX溶液中由水电离出来的c(H+)______________(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+),理由是___________________。
(1)将等质量的Zn粉分别投入:a:10 mL 0.1 mol·L-1 HCl和b:10 mL 0.1 mol·L-1醋酸中。
①若Zn不足量,则反应速率a_ _____b。(填“>”、“=”或“<”,下同)
②若Zn过量,产生H2的量a__ ____b。
(2)将等质量的Zn粉分别投入pH=1,体积均为10 mL的a:盐酸和b:醋酸中。
①若Zn不足量,则起始反应速率a__ ____b。
②若Zn过量,产生H2的量a_ _____b。