常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- |
| B.c(H+)/c(OH-)=10-10的溶液:K+、Ba2+、NO3-、Cl- |
| C.pH=0的溶液:Al3+、Ag(NH3) 2-、Cl-、SO42- |
| D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42- |
化学与生产、生活密切相关,下列说法正确的是()
| A.小苏打用于治疗胃溃疡病人的胃酸过多症 |
| B.电解从海水中得到的氯化钠溶液可获得金属钠 |
| C.铝制容器不能盛放酸性或碱性食品,但可长期盛放腌制食品 |
| D.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板 |
将11.2g镁−铜合金完全溶于足量的稀硝酸中,充分反应后,向所得溶液中加入过量的NaOH溶液,产生21.4g沉淀。反应过程中产生NO的体积(标准状况下)为
| A.4.48L | B.6.72L | C.11.2L | D.13.44L |
据国外媒体报道,iPhone5在电池方面有所改进,它将配备NEC自主研发的ORB超薄有机游离基电池,单次充电仅需30秒。该电池的一极为一种有机高分子的游离基(用R表示)和石墨粉及粘结剂的复合物,另一极是锂,分隔材料为某种聚烯烃,电解质为LiPF6溶解于某种有机碳酸酯溶剂中,高分子游离基在空气中十分稳定,在电池充电时被氧化成阳离子,而电池放电时又被还原成游离基。下列有关说法不正确的是
| A.放电时,该电池是将化学能转化为电能 |
| B.放电时,负极发生的反应是Li−e-=Li+ |
| C.充电时,Rx+ 由阴极向阳极移动 |
| D.充电时,阳极发生的反应是R−xe-=Rx+ |
取少量无机盐溶液试样,对其中的离子进行检验,下列判断正确的是
| A.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定含CO32- |
| B.加入KSCN溶液,无明显现象,再滴加几滴新制氯水,溶液变为血红色,则试样中一定含Fe2+ |
| C.加入BaCl2溶液,产生白色沉淀,再加入过量的稀盐酸酸化,沉淀不溶解,则试样中一定含SO42- |
| D.在酒精灯火焰上灼烧,火焰为黄色,则试样中一定含钠元素,一定不含钾元素 |
下列文字表述与反应方程式对应且正确的是
| A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Ag++Br-=AgBr↓ |
| B.可用碳酸钠溶液洗涤油污:CO32-+H2O=HCO3-+OH- |
C.用惰性电极电解饱和KCl溶液:2H++2Cl-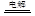 H2↑+Cl2↑ H2↑+Cl2↑ |
| D.FeSO4溶液与双氧水、稀硫酸混合:2Fe2++H2O2+2H+=2Fe3++2H2O |