2SO2+O2 2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
| A.使用催化剂不影响反应速率 |
| B.降低体系温度能加快反应速率 |
| C.增加O2的浓度能加快反应速率 |
| D.一定条件下达到反应限度时SO2全部转化为SO3 |
下列关于物质结构的说法中正确的是()
| A.BF3、HClO分子中所有原子都满足最外层8电子结构 |
| B.某元素原子最外层电子数是次外层电子数的a(a为整数)倍,则该原子核内质子数为2a+2 |
| C.D2O分子与H2O分子是所含电子总数不相等的分子 |
| D.在任何物质分子中都含有化学键 |
主链上有五个碳原子,分子中共有七个碳原子的烷烃,其结构式有()
| A.四种 | B.五种 | C.六种 | D.七种 |
下列各烃一定互为同系物的是( )
①CH4;②CH3—(CH2)4—CH3;③C2H4;④C6H12;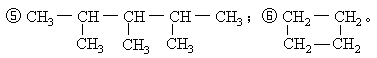
| A.③④⑥ | B.③④ | C.①③④⑥ | D.①②⑤ |
在2升的密闭容器中,发生以下反应:2A(g)+ B(g)  2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是()
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是()
| A.1.6 mol | B.1.6 mol | C.2.4 mol | D.2.8mol |
某种有机物完全燃烧只生成水和二氧化碳,对该有机物的组成元素判断正确的是()
A.只有C、H两元素 B.一定有C、H、O三元素
C.一定有C、H两元素 D.不能确定是否含有除C、H、O之外的其它元素