将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.6 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.15mol·L-1·s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为0.3 mol·L-1
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
下列溶液中有关物质的量浓度关系正确的是
A.0.2 mol/L的NaHCO3溶液: c(HCO3-)>c(CO32-)>0.1 mol/L>c(H2CO3) c(HCO3-)>c(CO32-)>0.1 mol/L>c(H2CO3) |
B.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合: c(Na+)>c(CH3COO-)>c(OH-)>c(H+) c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
C.0.2 mol/L CH3COOH溶液和0.2 mol/L CH3COONa溶液等体积混合: c(CH3COO-)+c(OH-)-c(H+)=0.1 mol/L c(CH3COO-)+c(OH-)-c(H+)=0.1 mol/L |
D.0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合 |
 c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+)
c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+)
在下列溶液中,各组离子一定能够大量共存的是
A.pH=2的溶液: Fe3+、Cu2+、SO42-、NO3- |
B.c(H+)=1×10-12mol/L的溶液:NH4+、K+、Cl-、AlO2- |
C.水电离的c(H+)=1×10-12mol/L的溶液:Na+、Al3+、Br-、ClO-  |
D.与铝反应放出氢气的溶液:Na+、Mg2+、Br-、Cl- |
科学家研制出多种新型杀虫剂代替DDT,化合物A是其中一种。下列关于化合物A的说法正确的是
A.与FeCl3溶液发生反应显紫色 |
B.能发生取代反应和银镜反应 |
C.分子中最多有5个碳原子共平面 |
D.与H2完全加成时的物质的量之比为1∶1 |
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是



| A.将海带灼烧成灰 | B.过滤得含I-溶液 | C.放出碘的苯溶液 | D.分离碘并回收苯 |
利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生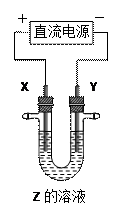
 产。下列说法中正确的是
产。下列说法中正确的是
A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 |
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4  |
C.电镀工业中,X是待镀金属,Y是镀层金属 |
D.外加电流的阴极保护法中,Y是待保护金属 |