下图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去)。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
⑴ 物质F的化学式 。
⑵ 物质B的电子式 。
⑶ 写出C→E的化学方程式 。
⑷ 写出G→E的离子方程式 。
把0.1molMnO2粉末加入50ml过氧化氢的溶液里(密度为1.1g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示。
(1)实验时放出气体的体积为。
(2)放出一半气体所需的时间约为。
(3)A、B、C、D各点反应速率由快到慢的顺序是。
(4)根据曲线形状解释反应速率变化的原因。
(5)计算反应前过氧化氢的物质的量浓度
(10)为比较铜与锌的金属活动性相对强弱,甲、乙、丙三位同学用中学化学常见的药品和仪器(用品),设计了下列实验。试回答下列问题:
(1)甲同学将锌插入CuSO4溶液中,结果锌片的表面析出一层红色的物质,该反应的离子方程式为。
(2)乙同学将铜片和锌片插入同一个盛有稀H2SO4的烧杯中(铜片和锌片不接触),观察到的现象是
(3)丙同学接着乙同学的实验,用导线将铜片和锌片连接起来组成原电池,此时作电池正板的是,负极的电板反应式为
(4)甲、乙、丙三位同学所设计的实验中能达到比较铜和锌的金属活动性相对强弱的实验目的的是(填字母)。
| A.只有甲同学 | B.甲和乙同学 |
| C.乙和丙同学 | D.甲,乙和丙同学 |
(10)氧族元素的各种性质可归纳整理如下(部分):
| 元素 性质 |
8O |
16S |
Se |
52Te |
| 单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
| 主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
| 原子半径(nm) |
0.074 |
0.102 |
0.116 |
0.143 |
| 单质与H2反应 |
点燃易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
回答下列问题:
(1)氧离子的结构示意图为,硫离子的电子式为。
(2)碲的主要化合价可能有。
(3)氧元素比硫无素非金属性(填强和弱)。请用化学方程式证明该结论:
(4)H2O2可以作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式:
(10)已知A、B、C、D为原子序数依次增大的短周期元素,其中A、D同主族.A元素的单质是密度最小的气体,B元素原子的最外层电子数是次外层电子数的2倍,且其最外层电子数比C元素原子的最外层电子数少2。
试回答下列问题:
(1)写出B的元素符号:。
(2)C在元素周期表中的位置为。
(3)写出BA4的电子式:
(4)用电子式表示离子化合物D2C的形成过程。
(5)写出D2C2与A2C反应的化学方程式:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。回答下列问题: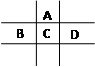
(1)①A与E形成的化合物的化学式是。
②B的最高价氧化物化学式为。
③C的元素名称为。
(2)D的单质与水反应的方程式为:。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是,有关反应的离子方程式为:
,。