下列关于溶液和胶体的叙述,正确的是 ( )。
| A.溶液是电中性的,胶体是带电的 |
| B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 |
| C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
室温时,下列混合溶液的pH一定小于7的是
| A.pH=3的盐酸和pH=11的氨水等体积混合 |
| B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 |
| C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 |
| D.pH=3的硫酸和pH=11的氨水等体积混合 |
25℃时,水的电离达到平衡:H2O≒H++OH﹣△H>0,下列叙述正确的是
| A.向水中加入氢氧化钠,平衡逆向移动,c(H+)降低,c(OH﹣)增大 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,c(H+)不变 |
合成氨反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是()
2NH3(g)ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是()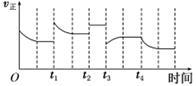
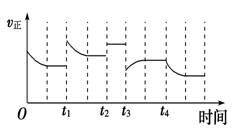
| A.t1时增大了压强 | B.t2时充入了稀有气体 |
| C.t3时升高了温度 | D.t4时降低了温度 |
根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g) 2HI(g);△H=-9.48 kJ·mol-1
2HI(g);△H=-9.48 kJ·mol-1
(ii)I2(S)+ H2(g) 2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
| A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B.反应(i)的产物比反应(ii)的产物稳定 |
| C.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| D.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
下列措施或事实不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.在合成氨的反应中,降温或加压有利于氨的合成 |
| D.Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅 |