、下图是某学校实验室从化学试剂商店买回来的硫酸试剂标签上的部分内容。据此下列说法正确的是( )
| A.该硫酸的物质的量浓度为9.2 mol·L-1 |
| B.该硫酸50 mL与足量的铜反应可得到标准状况下SO2 0.46 mol |
| C.要配制250 mL 4.6 mol·L-1的稀硫酸需取该硫酸62.5 mL |
| D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 mol·L-1 |
下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是
| A.K+ MnO4- Cl- SO42- | B.Na+ AlO2- Cl- SO42- |
| C.SO42-Na+HCO3-Ba2+ | D.Na+ NO3- NH4+ SO42- |
北京2008奥运会金牌直径为70 mm,厚6 mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)制成。为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误
| A.硫酸铜溶液 | B.氢氧化钠溶液 | C.稀硝酸 | D.硝酸银溶液 |
以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
| 氧化物 |
环境问题 |
主要来源 |
|
| A |
CO2 |
酸雨 |
化石燃料的燃烧 |
| B |
SO2 |
光化学烟雾 |
汽车尾气的排放 |
| C |
NO2 |
温室效应 |
工厂废气的排放 |
| D |
CO |
CO中毒 |
燃料的不完全燃烧 |
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.CO2的电子式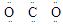 |
B.Cl-的结构示意图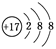 |
C.氨分子的球棍模型: |
D.质量数为37的氯原子Cl |
国家核事故应急协调委员会2011年4月4日权威发布:我国内地31个省、自治区、直辖市部分地区空气中监测到来自日本核事故释放出的极微量人工放射性核素131I。下列有关说法正确的是
| A.131I与127I互为同素异形体。 | B.131I比127I多4个质子 |
| C.131I与127I是同一核素 | D.131I与127I互为同位素 |