已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO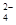 +4H+ +4H+ |
| B.I2+SO2+2H2O===H2SO4+2HI |
| C.2Fe2++I2===2Fe3++2I- |
| D.H2O2+SO2===H2SO4 |
1.76 g铜镁合金完全溶解于50 mL、密度为1.40 g/cm3、质量分数为63%的浓硝酸中,得到NO2气体1792 mL。(标准状况),向反应后的溶液中加入适量的1.0 mol/LNaOH溶液,恰好使溶液中的金属离子全部沉淀。下列说法不正确的是
| A.加入NaOH溶液的体积是50 mL |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0. 08 mol |
| D.得到的金属氢氧化物沉淀的质量为3. 12 g |
下列说法正确的是
| A.能自发进行的化学反应一定是△H<O、△S>O |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含40.O g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 KJ |
C.已知2H2(g)+O2(g) 2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol 2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
D.已知2C(s)+2O2(g) 2CO2(g)△H=akJ/mol、2C(s)+O2(g) 2CO2(g)△H=akJ/mol、2C(s)+O2(g) 2CO(g)△H=bkJ/mol,则a>b 2CO(g)△H=bkJ/mol,则a>b |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。下列说法正确的是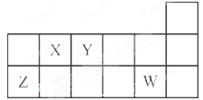
| A.原子半径的大小顺序:rZ>rY>rX |
| B.氢化物的稳定性强弱顺序XH4>YH3>HW |
| C.Y的氢化物与W的氢化物化合所得产物中只含有共价键 |
| D.X、Y、Z、W四种元素的最高价氧化物对应水化物均能与强碱反应 |
化学中常用图象直观地描述化学反应的进程或结果,下列图象描述正确的是
| A.图①可以表示某化学平衡体系改变温度后,反应速率随时间的变化 |
| B.图②中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0未使用和使用催化剂时,反应过程中的能量变化 |
C.图③表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,且甲的压强大 3C(g)+D(g)的影响,且甲的压强大 |
D.图④中曲线表示反应2SO2(g)+O2(g) 2SO3(g)△H<0逆反应的平衡常数K随温度的变化 2SO3(g)△H<0逆反应的平衡常数K随温度的变化 |
N2O5是一种新型硝化剂,在一定温度下可发生如下反应:
2N2O5(g) 4NO2(g)+O2(g) △H>0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) △H>0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s |
0 |
500 |
1000 |
1500 |
| c(N2O5)/mol•L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是
A.500 s内,N2O5的分解速率为2.96×10-3mol/(L·min)
B.若T1温度下的平衡常数K1=125,则平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)>5.00mol•L-1