Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):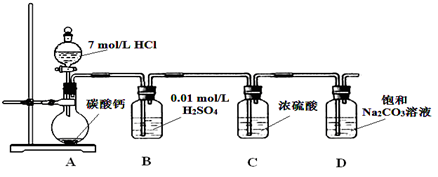
(1)请结合化学平衡移动原理解释B中溶液的作用 。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程式是 。
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题: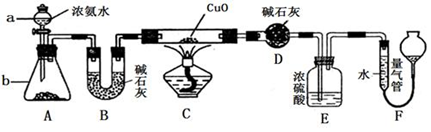
(1)仪器b中可选择的试剂为(任意填一种) 。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为 。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积 (填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据 (填序号)。
a.B装置实验前后质量差mg; b.F装置实验前后液面差VL
c.D装置实验前后质量差mg; d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是 。
有机物A分子组成为C4H9Br,分子中有一个甲基支链,在一定条件下A发生如下转化:
已知:不对称烯烃与HBr加成反应时,一般是Br加在含氢较少的碳原子上,如: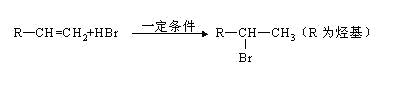
(1)A的结构简式为B~H中,与A互为同分异构体的有机物是(填字母代号)
(2)上述转化中属于取代反应的有(填序号)
(3)C的结构简式为
(4)写出反应④的化学方程式:
(1)系统命名法命名下列物质
①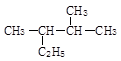 _______________
_______________
②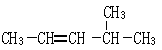 ___________________
___________________
(2)某有机化合物A的相对分子质量(分子量)为134。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
①该化合物分子中含有个氧原子
②该化合物的分子式是。
③该化合物分子中最多含个>C=O官能团。
(3)读图题:已知1-丙醇和2-丙醇的结构简式如下:
1-丙醇: 2-丙醇:
2-丙醇:
下图是这两种物质的其中一种的核磁共振氢谱,并且峰面积比分别为1:1:6,
请指出具有该核磁共振氢谱的物质是(写名称)
右图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: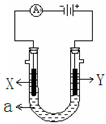
(1)若X、Y都是惰性石墨电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,在X极附近观察到的现象是________;Y电极上的电极反应式是________,将Y电极反应产物通入Na2S溶液观察到的现象是________。电解NaCl溶液的离子方程式是________________。某厂现有50台电解槽,每台平均每天消耗2.925×105 g食盐,电解生成的Cl2与H2按体积比1:1.15合成质量分数为36.5%的盐酸。不考虑损耗,理论上一天可生产36.5%的盐酸t。(保留三位有效数字)
(2)若要在铁制品上镀一定厚度的Ag,Y电极反应式为,工作一段时间后pH将(填“增大”或“减小”或“不变”)
(3)若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g。该金属的相对原子质量是。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的氧化物,实验室以孔雀石为原料制备CuSO4·5H2O,步骤如下:
(1)写出Cu2(OH)2CO3在水中的沉淀溶解平衡方程式,溶液A的金属离子有Cu2+、Fe2+、Fe3+。检验溶液A中Fe3+的最佳试剂为,试剂①为(从下列所给字母中选填,下同)
a.KMnO4 b.KI c.H2O2 d.KSCN
(2)写出溶液A到溶液B的离子方程式_________
(3)试剂②是CuO,还可以是下列的,作用是。
a.CuCl2 b.CuCO3 c.Cu(OH)2 d.CuSO4
(4)沉淀C的化学式为。
(12分)①制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂。把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数。实验重复3次。记录见下表。
| 滴定次数 |
NaOH溶液体积/mL |
滴定消耗滤液体积/mL |
| 1 |
25.00 |
20.02 |
| 2 |
25.00 |
17.10 |
| 3 |
25.00 |
19.98 |
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________________。
(2) 配制成250mL溶液使用的量具是,指示剂还可用____________;
(3) 滴定终点的现象是_______________________。
(4) 滤液中溶质的物质的量浓度为_____________。
(5) 若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果________。 (填“偏高”、“偏低”或“无影响”)