绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究: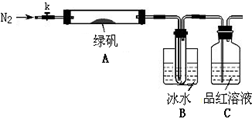
FeSO4•7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是 ;
结论2:C中溶液褪色,可推知产物中有 ;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足: 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是 。
a.氯水和KSCN溶液 b.酸性KMnO4溶液 c.H2O2 d.NaOH溶液
由于钠很容易与空气中的、等物质反应,所以钠在自然界里只能以_________态存在。
A、B、C、D为单质,其余物质为化合物。A为银白色金属,D为黑色固体非金属,X在常温下是无色液体,B、C、J在常温下为气体。分别用铂丝蘸取少许E、F、H、I溶液,在无色火焰上灼烧,火焰呈黄色。将J通入澄清石灰水,石灰水先变浑浊,继续通J一段时间,石灰水又变澄清。物质间有如下图转化关系。(图中省略部分反应物和生成物)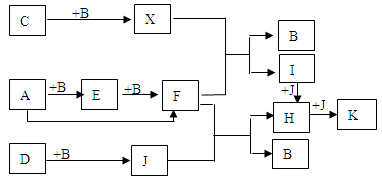
(1)请写出下列物质的化学式:
A:B:X:J:
(2)写出下列变化中的化学反应方程式,是离子反应的,写离子反应方程式。
①A→F;
②X+F→B+I
(3)F在生产和生活中具有重要作用,写出F的一种用途。
(4)如果I溶液中混有H,要除去H应加适量___溶液(填化学式),离子方程式为 。
为探索工业含铝、铁、铜合金废料的再利用,某同学实验设计的回收利用方案如下: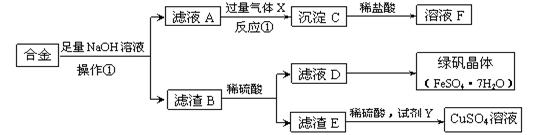
(1)操作①的名称是 , 滤渣B含有(填化学式)。
(2)反应①的离子方程式是。
(3)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有(填序号)。
A.漏斗B.坩埚C.烧杯D.玻璃棒
(4)试剂Y应该是一种(填“氧化剂”或“还原剂”),它不可能是(填序号)。
A.H2O2B.H2C.O2D.Fe
(原创)(1)除去碳酸钠固体中少量碳酸氢钠的方法是,化学方程式为 。
(2)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
Fe(OH)3 +ClO-+OH-===FeO42-+Cl-+()
(3)某溶液中可能大量含有Mg2+、Cu2+、Al3+、Cl-、OH-、CO32-。当加入氢氧化钠溶液时,生成白色沉淀的
物质的量与加入氢氧化钠的物质的量关系如图所示。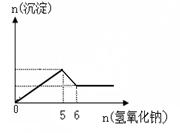
则溶液中大量含有的离子有______________________,各离子的物质的量浓度之比为____(与前面的离子顺序相对应)。
一同学将一小块金属钠露置于空气中,观察到下列现象:银白色 变灰暗
变灰暗 变白色
变白色 出现液滴
出现液滴 白色固体,下列说法正确的是
白色固体,下列说法正确的是
| A.①发生了氧化还原反应 |
| B.②变白色是因为生成了碳酸钠 |
| C.③是碳酸钠吸收空气中的水蒸气形成了溶液 |
| D.④只发生物理变化 |