(原创)(1)除去碳酸钠固体中少量碳酸氢钠的方法是 ,化学方程式为 。
(2)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
Fe(OH)3 + ClO-+ OH-=== FeO42-+ Cl-+ ( )
(3)某溶液中可能大量含有Mg2+、Cu2+、Al3+、Cl-、OH-、CO32-。当加入氢氧化钠溶液时,生成白色沉淀的
物质的量与加入氢氧化钠的物质的量关系如图所示。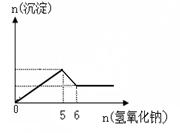
则溶液中大量含有的离子有______________________,各离子的物质的量浓度之比为____ (与前面的离子顺序相对应)。
碱式碳酸铜[Cu2(OH)2C03]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
查阅资料知,通过调节溶液的酸碱性可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀pH |
6.0 |
7.5 |
1,4 |
| 沉淀完全pH |
13 |
14 |
3.7 |
(1)氯酸钠的作用是;
(2)调节溶液A的pH范围为,可以选择的试剂是.(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净。
(12分)原子序数小于36的x、Y、z、w四种元素,元素x的原子核外最外层电子数是内层电子数的2倍,元素Y与x同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,z是x的同族相邻元素;w是第Ⅷ族元素中原子序数最小的元素。用元素符号回答下列问题:
(1)X、Y、Z的电负性由小到大的顺序是。
(2) N3一与x、Y形成的一种化合物互为等电子体,则N3一的空间构型为、电子式为。
(3)同为原子晶体的XY2与ZY2中硬度小的是。
(4)X和W所形成的某种晶体结构如图7所示,写出:
①基态W2+离子的价电子排布式;
②该晶体的化学式。
某学生试图用电解法根据电极上析出物质的质量来验证阿伏伽德罗常数的值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如图:
②在电流为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g.
试回答:
(1)连接这些仪器的正确顺序为:(用图中标注仪器接线柱的英文字母表示,下同)E接________,C接________,________接F.
(2)写出B电极上发生反应的离子方程式________________.G试管中淀粉KI溶液变化的现象为__________________,相应的离子方程式是__________________.
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是________.(选填下列操作步骤的编号)
①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次低温烘干后称量至恒重
(4)已知电子的电荷量为1.6×10-19C.试列出阿伏伽德罗常数的计算表达式:NA=________.
二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下: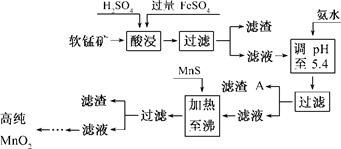
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 |
pH |
| Al(OH)3 |
5.2 |
| Fe(OH)3 |
3.2 |
| Fe(OH)2 |
9.7 |
| Mn(OH)2 |
10.4 |
| Cu(OH)2 |
6.7 |
| Zn(OH)2 |
8.0 |
| CuS |
≥-0.42 |
| ZnS |
≥2.5 |
| MnS |
≥7 |
| FeS |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________________.
(2)滤渣A的主要成分为________.
(3)加入MnS的目的是除去________杂质.
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为__________________________.
(5)从废旧碱性锌锰干电池中可以回收利用的物质有________(写出两种).
在玻璃圆筒中盛有两种无色的互不相溶的中性液体,上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图.接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.根据上述实验回答: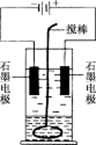
(1)阳极上的电极反应式为________.
(2)阴极上的电极反应式为________.
(3)原上层液体是________.
(4)原下层液体是________.
(5)搅拌后两层液体颜色发生变化的原因是__________________________________.
(6)要检验上层液体中含有的金属离子,其方法是______________________________,现象是__________________________________.